7.5: Monóxido de Carbono
- Page ID
- 69522
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)El monóxido de carbono (CO) es isoelectrónico con nitrógeno (N 2) y se forma a través de la combustión incompleta de carbono, (7.5.1), o compuestos hidrocarbonados.
\[ \text{2 C + O}_2 \rightarrow \text{ 2 CO}\]
El monóxido de carbono también puede estar hecho de vapor y carbón como parte del gas de síntesis, (7.4.2). Una preparación conveniente de laboratorio de CO es la deshidratación del ácido fórmico por ácido sulfúrico, (7.4.3).
\[ \text{C + H}_2\text{O} \rightarrow \text{CO + H}_2 \]
\[ \text{HCO}_2\text{H} \rightarrow \text{CO + H}_2\text{O}\]
Peligros y toxicidad
El monóxido de carbono es inflamable, (7.4.4), y tiene un límite explosivo de 12.5 — 74% con una temperatura de autoignición de 609 °C.
\[\text{2 CO + O}_2 \rightarrow \text{2 CO}_2\]
El monóxido de carbono también es muy tóxico; sin embargo, es incoloro, inodoro, insípido y no irritante, todo lo cual aumenta su peligro. La combustión incompleta de hidrocarburos (gas natural o gasóleo para calefacción) o fuentes de carbono (carbón o carbón) es un peligro común en el hogar. En un ambiente cerrado (por ejemplo, parrilla de carbón en habitación sin ventilación o mala) ya que el carbono consume oxígeno en la habitación, la formación de monóxido de carbono tóxico resulta en lugar de dióxido de carbono (CO 2) .Las fuentes típicas de CO en el hogar se muestran en la Figura\(\PageIndex{1}\).
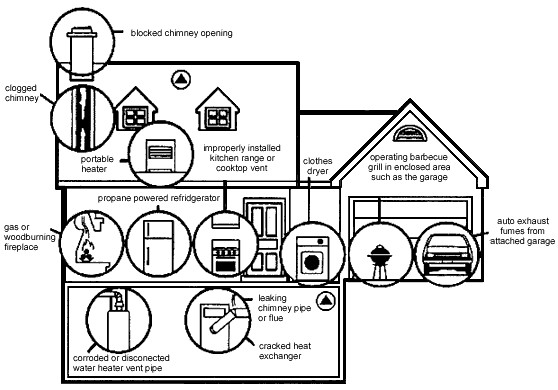
La toxicidad del CO se debe a su competencia con el oxígeno en el sitio de unión al hemo en la hemoglobina. La afinidad de unión por CO es 200 veces mayor que la del oxígeno, lo que significa que solo pequeñas cantidades de CO reducen drásticamente la capacidad de la hemoglobina para transportar oxígeno alrededor del cuerpo. El color rojo brillante del complejo Co-heme es la razón por la que la exposición crónica da como resultado que la piel adopte un color rojo brillante. Los síntomas de intoxicación por CO incluyen dolor de cabeza, náuseas, debilidad y eventualmente la muerte. Cuando el aire contiene niveles de CO tan bajos como 0.02%, ocurren cefalea y náuseas; si la concentración de CO se incrementa a 0.1%, seguirá la inconsciencia.
Nota
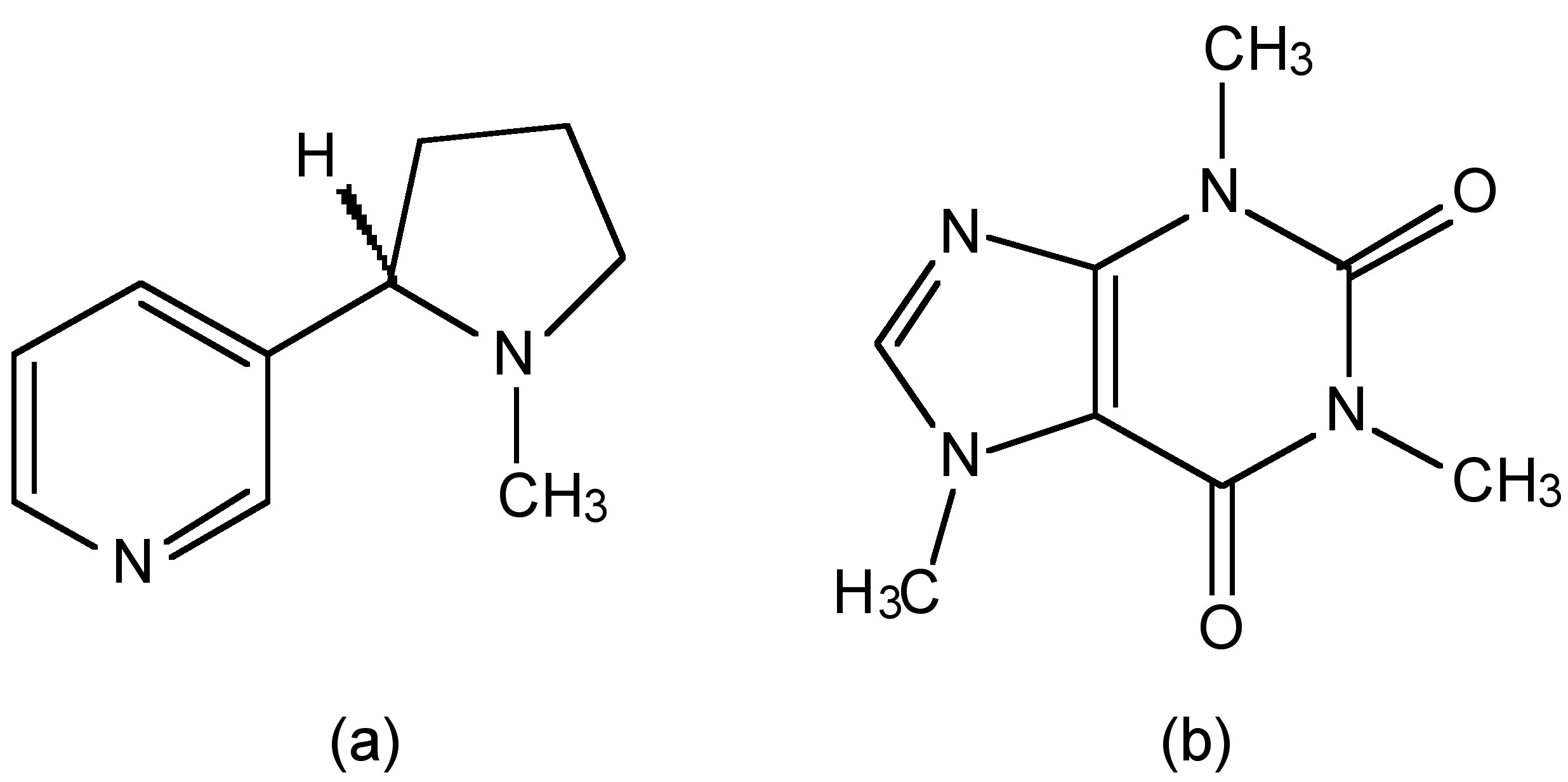
Humo de cigarrillo que contiene grandes cantidades de monóxido de carbono y como resultado los fumadores pesados pueden tener hasta 20% de los sitios activos de oxígeno en su sangre bloqueados por CO. No obstante, a pesar de este peligro, los cigarrillos serían aún más mortíferos si no se quemaran. Un ingrediente clave (y a menudo diseñado) en los cigarrillos es la droga adictiva nicotina. La nicotina es un alcaloide (Figura\(\PageIndex{2}\) a) al igual que la cafeína (Figura\(\PageIndex{2}\) b) que se encuentra en el café y el té. La dosis letal de cafeína es de aproximadamente 10 g, lo que se relaciona con aproximadamente 70 — 100 tazas de café (asumiendo una concentración de 100- 150 mg por taza). Alternativamente, una dosis letal de cafeína de cola requeriría aproximadamente 180 — 280 botellas de 12 oz, cada una conteniendo 35 — 44 mg. En comparación la nicotina tiene una dosis letal de 50 mg. Esto significa que 12 cigarrillos pueden proporcionar una dosis letal si se consumen. La única razón por la que fumar 12 cigarrillos no matan de inmediato es que la mayor parte de la nicotina se quema al fumar el cigarrillo. Si esto no fuera cierto ¡los fumadores serían asesinados antes de que pudieran desarrollar un hábito!
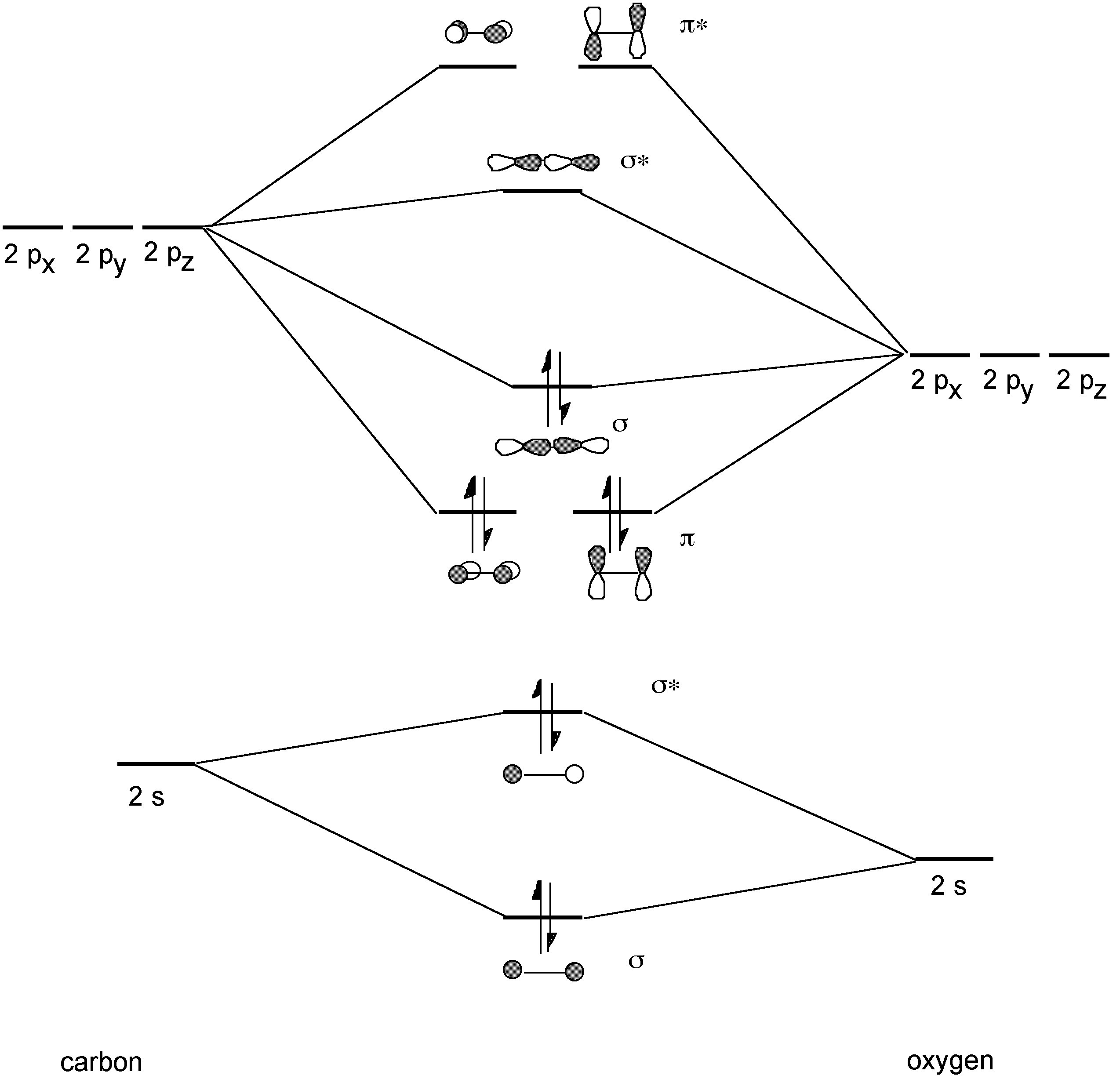
Estructura y unión
La unión en CO implica 1 enlace σy 2 juegos de enlaces π (Figura\(\PageIndex{3}\)). La distancia de enlace C-O en monóxido de carbono es de 1.1 Å y por lo tanto es consistente con un triple enlace. En comparación, un enlace sencillo C-O típico es de aproximadamente 1.43 Å, y un doble enlace C-O promedio es de aproximadamente 1.23 Å. La mayor banda de absorción en el espectro infrarrojo para CO es 2143 cm -1, mientras que para 13 CO es 2099.2 cm -1.