7.6: Dióxido de Carbono
- Page ID
- 69523
El dióxido de carbono (CO 2) es el óxido de carbono más estable y se forma a partir de la quema de carbono o compuestos que contienen carbono en el aire o un exceso de oxígeno, (7.6.1). Para aplicaciones industriales se suele preparar a partir de la descomposición del carbonato de calcio (piedra caliza), (7.6.2), en lugar de la separación de los productos de combustión.
\[ \text{C + O}_2 \rightarrow \text{CO}_2\]
\[ \text{CaCO}_3 \rightarrow \text{CaO + CO}_2\]
Química de fase del dióxido de carbono
El dióxido de carbono no existe como líquido a presión atmosférica normal, sino que el CO 2 sólido (también conocido como hielo seco) se sublima a -78.5 °C (Figura\(\PageIndex{1}\)). El hielo seco (Figura\(\PageIndex{2}\)) se usa comúnmente como refrigerante para la conservación de alimentos o muestras biológicas.


Nota
Cuando se coloca hielo seco en el agua (especialmente calentada), la sublimación se acelera y se crea una densa nube de niebla (similar al humo) de bajo hundimiento. Esto se usa en máquinas de niebla, en teatros, conciertos, casas embrujadas y clubes nocturnos para efectos dramáticos (Figura\(\PageIndex{3}\)). La niebla del hielo seco flota sobre el suelo a diferencia de otras máquinas de niebla artificial (que utilizan combustión parcial de aceite) donde la niebla se eleva como humo.

Dióxido de carbono supercrítico
Como se señaló anteriormente, el dióxido de carbono generalmente se comporta como un gas en el aire a temperatura y presión estándar (STP = 25 °C y 1 atm) o como un sólido cuando se congela. Sin embargo, si tanto la temperatura como la presión se incrementan desde STP para estar en o por encima del punto crítico (Figura\(\PageIndex{1}\)), el dióxido de carbono adopta propiedades a medio camino entre un gas y un líquido (T c = 31.1 °C y P c = 72.9 atm).
El CO 2 supercrítico se ha convertido en un importante solvente industrial debido a su papel en la extracción química además de su baja toxicidad e impacto ambiental. En este sentido se ve como un prometedor solvente verde. Una de las mayores aplicaciones es la descafeinación de café y té sin dejar ningún residuo y permitir que la cafeína se separe y se use en otros productos de bebidas.
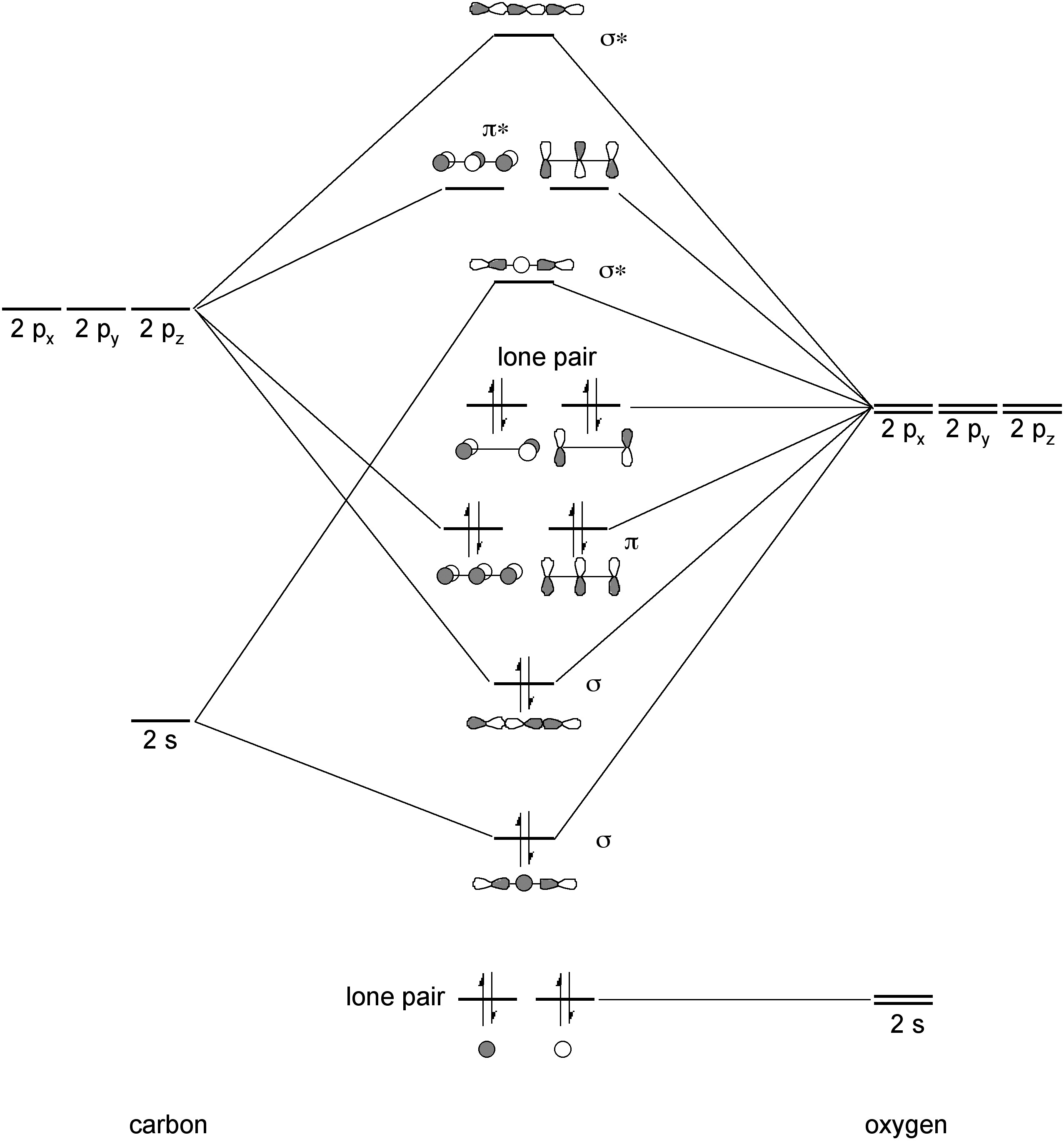
Estructura y unión
El dióxido de carbono es una molécula lineal debido a la localización π. La unión en CO 2 implica 2 enlaces σ-y 2 juegos de 3 enlaces π centrales (Figura\(\PageIndex{4}\)). La longitud del enlace C-O de 1.2 Å debe compararse con el valor observado para los carbonilos orgánicos (e.g., cetonas, ésteres, aldehídos) de 1.2 — 1.3 Å.
Disolución y reacción con agua
Aunque el CO 2 no tiene momento dipolar es muy polar (constante dieléctrica = 1.60 a 0 °C, 50 atm) y consecuentemente se disuelve en disolventes polares como el agua hasta una concentración de 18% (0.04 M). La mayor parte (+99%) está presente como CO 2 solvatado (Figura\(\PageIndex{5}\)), y solo se hace reaccionar ca. 0.2% para formar ácido carbónico, (7.6.1), con equilibrios posteriores que resultan en la formación de bicarbonato (HCO 3 -) y carbonato (CO 3 2-).
\[ \text{H}_2\text{O + CO}_2 \rightarrow \text{H}_2\text{CO}_3\]
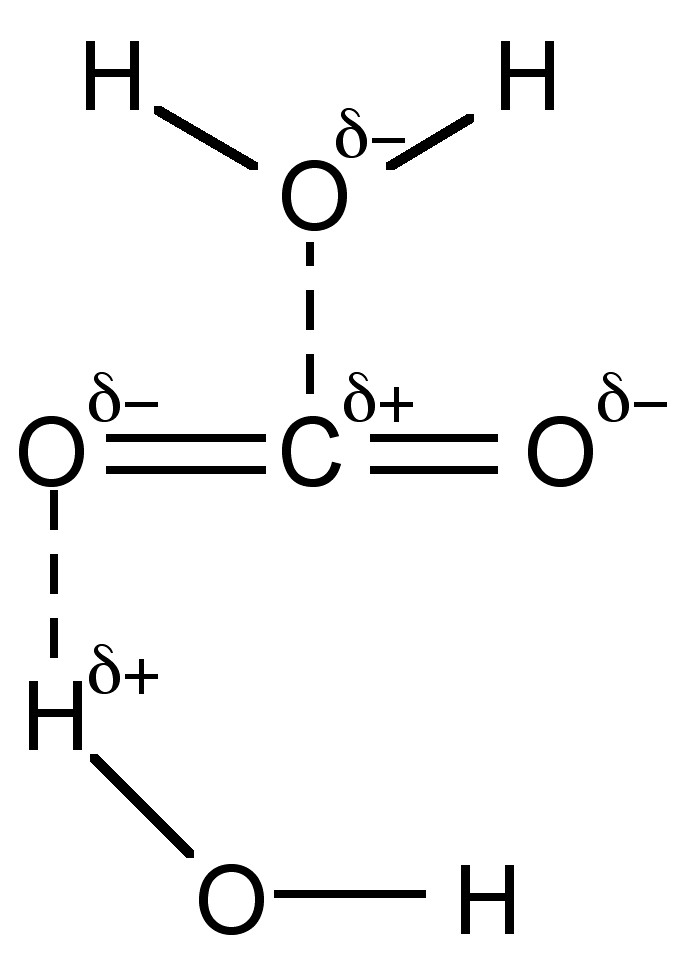
La reacción global implica una serie de equilibrios. El primer equilibrio es la formación de ácido carbónico, (7.6.4). Las velocidades de reacción, (7.6.5), están en la magnitud de 1 segundo (es decir, lentas), y como consecuencia cuando el dióxido de carbono es transportado en el cuerpo hay una enzima presente para acelerar la reacción.
\[ \text{CO}_{\text{2(solv)}} \text{ + H}_2\text{O} \xrightleftharpoons[\text{k}_{\text{H}_2\text{CO}_3}]{\text{k}_{\text{CO}_2}} \text{H}_2\text{CO}_3\]
\[ \text{K = } \dfrac{\text{k}_{\text{H}_2\text{CO}_3}}{\text{k}_{\text{CO}_2}} \text{ = } \dfrac{25}{0.04} \text{ = 600}\]
El segundo equilibrio es como consecuencia de la primera ionización del ácido carbónico para formar bicarbonato (HCO 3 -), (7.6.6). En contraste con la primera reacción, (7.6.4), esta reacción es muy rápida con una K eq = 1.6 x 10 -4 @ 25 °C.
\[ \text{H}_2\text{CO}_3 \rightleftharpoons \text{HCO}_3^- \text{ + H}^+ \]
El tercer equilibrio implica la formación del ion carbonato (7.6.7), y tiene un K eq = 4.84 x 10 -11. El carbonato (CO 3 2-) es un ligando deslocalizado, que puede actuar como un grupo mono o bidentado o puente.
\[ \text{HCO}_3^- \rightleftharpoons \text{CO}_3^{2-} \text{ + H}^+ \]
La formación de ácido carbónico es la razón de que incluso en ausencia de contaminantes (como el SO 2) el agua de lluvia natural es ligeramente ácida debido al CO 2 disuelto. El equilibrio asociado con el ácido carbónico también es responsable del amortiguamiento del pH en la sangre.
Química de reacción
La fotosíntesis en plantas reduce el CO 2 a materia orgánica, pero aún no se han desarrollado reacciones similares en sistemas no vivos.
Los Grignards reaccionan fácilmente con el dióxido de carbono para formar el carboxilato, que produce el ácido carboxílico asociado tras la hidrólisis, (7.6.8). Reacciones similares ocurren con otros compuestos organometálicos. Además, el CO 2 reacciona con sales de metales alcalinos de fenoles (fenolatos) para producir el hidroxi-carboxilato.
\[ \text{RMgX + CO}_2 \rightarrow \text{RCO}_2\text{MgX} \xrightarrow{\text{H}_2\text{O}} \text{RCO}_2\text{H + HOMgX}\]
Se conocen varios complejos de CO 2 con metales de transición en los que la coordinación puede ocurrir a través del carbono central (Figura\(\PageIndex{6}\) a) o el enlace C=O (Figura\(\PageIndex{6}\) b). Alternativamente, el CO 2 puede puentear dos centros metálicos.

Calentamiento global y dióxido de carbono
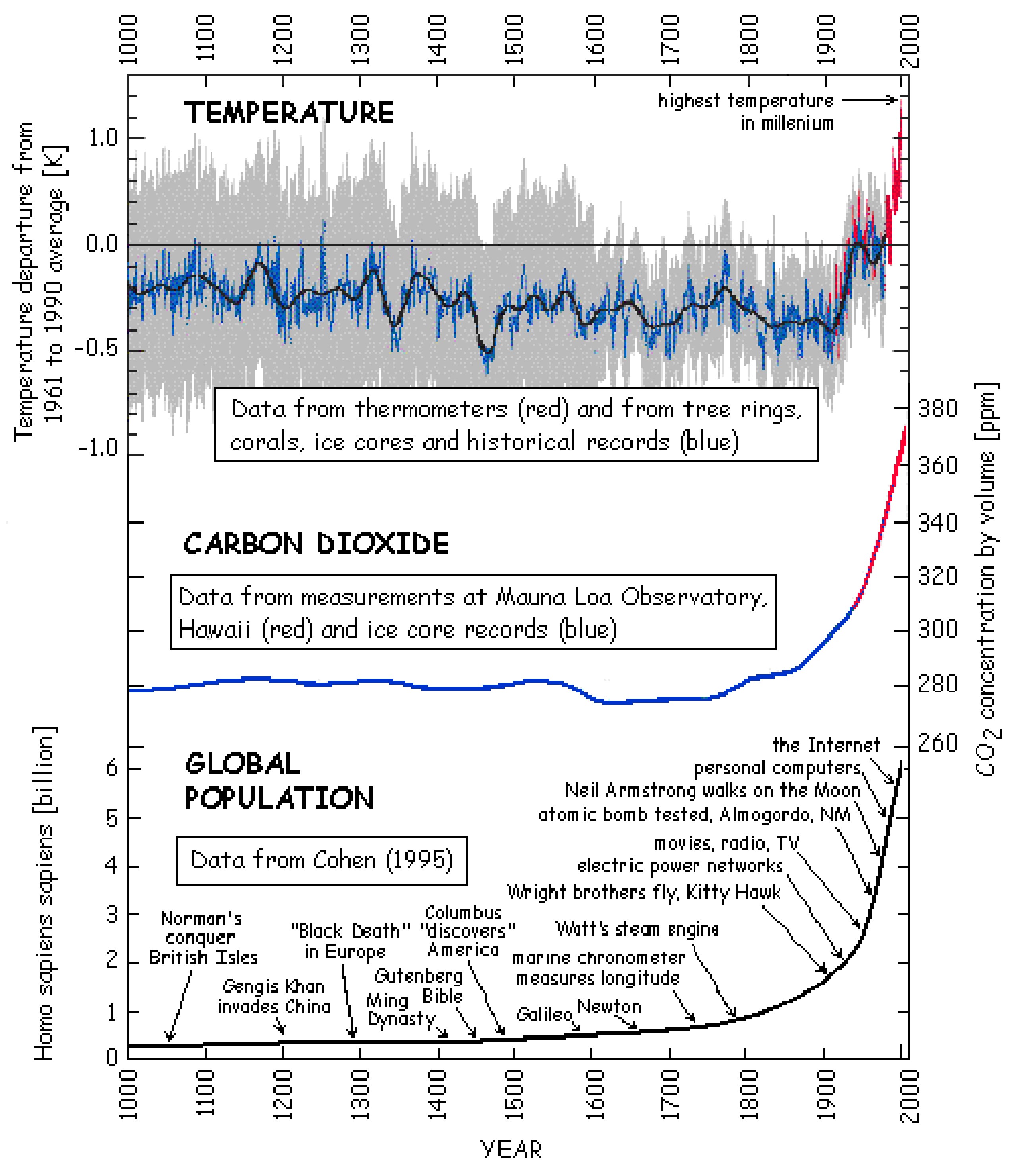
El calentamiento global es el proceso del aumento observado en la temperatura promedio del aire y los océanos cercanos a la superficie de la Tierra desde mediados del siglo XX. La temperatura global de la superficie aumentó 0.74 °C (1.33 °F) entre el inicio y el final del siglo XX (Figura\(\PageIndex{7}\)). En general se concuerda que la mayor parte de este aumento de temperatura se ha producido desde mediados del siglo XX y fue causado por el aumento de las concentraciones de gases de efecto invernadero resultantes de la quema de combustibles fósiles (la generación de CO 2 adicional) y la deforestación (la pérdida de un mecanismo para el consumo de CO 2), ver Figura\(\PageIndex{7}\). Si bien se aprecia que los fenómenos naturales (incluyendo la radiación solar y los volcanes) produjeron la mayor parte del calentamiento desde tiempos preindustriales, la magnitud de los cambios provocados por la industrialización global es más significativa.
La atmósfera terrestre tiene dos funciones. Primero, el ozono (O 3) en la atmósfera superior evita que los rayos UV dañinos lleguen a la superficie de la Tierra. Segundo, a medida que la radiación solar penetra en la atmósfera, una porción del calor se retiene como consecuencia del CO 2 en la atmósfera. Es este proceso el que modula la temperatura de la superficie y proporciona un ambiente estable de por vida. El fracaso o alteración de cualquiera de estos procesos puede tener un efecto dramático en la habitabilidad de un planeta.
Considere la posición relativa de Venus, la Tierra y Marte con respecto al Sol (Figura\(\PageIndex{8}\)). Cuanto más cerca está un planeta del sol, mayor es la radiación UV y mayor es el calentamiento del planeta; sin embargo, la temperatura también es modulada en gran medida por la atmósfera. Venus tiene una atmósfera que comprende 95% CO 2 y tiene una temperatura superficial de aproximadamente 450 °C, en contraste, mientras que la atmósfera de Marte también es 95% CO 2, es solo 1% tan densa como la de la Tierra, y por lo tanto las temperaturas superficiales oscilan entre 40 °C durante el día (debido al calentamiento radiativo) a —80 °C por la noche (debido a la falta de calor retenido debido a la atmósfera delgada). Estos deben compararse con la atmósfera de la Tierra que es 0.038% de CO 2, lo que permite retener la cantidad correcta de calor para sostener la vida. Claramente, cualquier cambio significativo en el contenido de CO 2 de la atmósfera cambiará las temperaturas globales de un planeta.
Bibliografía
- N. Stern, The Stern Review: The Economics of Climate Change, HM Treasury, Londres.
- R. B. Gupta y J.-J. Shim, Solubilidad en Dióxido de Carbono Supercrítico, CRC Press (2006).
- Captura y almacenamiento de dióxido de carbono: Informe Especial del Panel Intergubernamental sobre Cambio Climático, Cambridge University Press (2005).


