7.10: Silicio de Grado Semiconductor
- Page ID
- 69530
Introducción
La síntesis y purificación de material semiconductor policristalino a granel representa el primer paso hacia la fabricación comercial de un dispositivo electrónico. Este material policristalino se utiliza entonces como materia prima para la formación de material monocristalino que se procesa en obleas semiconductoras. La fuerte influencia en las características eléctricas de un semiconductor exhibida por pequeñas cantidades de algunas impurezas requiere que la materia prima a granel sea de muy alta pureza (> 99.9999%). Aunque es posible algún nivel de purificación durante el proceso de cristalización, es importante usar un material de partida de la mayor pureza posible.
Después del oxígeno (46%), el silicio (L. silicis pedernal) es el elemento más abundante en la corteza terrestre (28%). Sin embargo, el silicio no se presenta en su forma elemental, sino como su óxido (SiO 2) o como silicatos. Arena, cuarzo, amatista, ágata, pedernal y ópalo son algunas de las formas en las que aparece el óxido. Granito, hornblende, amianto, feldespato, arcilla y mica, etc. son algunos de los numerosos minerales de silicato. Con tales suministros ilimitados de la materia prima, los costos asociados a la producción de silicio a granel no son de abstracción y conversión del (de los) óxido (s), sino de purificación del silicio elemental crudo. Mientras que el 98% de silicio elemental, conocido como silicio de grado metalúrgico (MGS), se produce fácilmente a gran escala, los requisitos de pureza extrema para la fabricación de dispositivos electrónicos requieren etapas de purificación adicionales para producir silicio de grado electrónico (EGS). El silicio de grado electrónico también se conoce como silicio de grado semiconductor (SGS). Para que los niveles de pureza sean aceptables para el crecimiento posterior de los cristales y la fabricación de dispositivos, EGS debe tener niveles de impurezas de carbono y oxígeno inferiores a unas pocas partes por millón (ppm), e impurezas metálicas en el rango de partes por mil millones (ppb) o menor. Tabla\(\PageIndex{1}\) y Tabla\(\PageIndex{2}\) dan concentraciones típicas de impurezas en MGS y EGS, respectivamente. Además de la pureza, el costo de producción y las especificaciones deben satisfacer los deseos de la industria.
| Element | Concentración (ppm) | Element | Concentración (ppm) |
| aluminio | 1000-4350 | manganeso | 50-120 |
| boro | 40-60 | molibdeno | < 20 |
| calcio | 245-500 | níquel | 10-105 |
| cromo | 50-200 | fósforo | 20-50 |
| cobre | 15-45 | titanio | 140-300 |
| hierro | 1550-6500 | vanadio | 50-250 |
| magnesio | 10-50 | circonio | 20 |
| Element | Concentración (ppb) | Element | Concentración (ppb) |
| arsénico | < 0.001 | oro | < 0.00001 |
| antimonio | < 0.001 | hierro | 0.1-1.0 |
| boro | ≤ 0.1 | níquel | 0.1-0.5 |
| carbono | 100-1000 | oxígeno | 100-400 |
| cromo | < 0.01 | fósforo | ≤ 0.3 |
| cobalto | 0.001 | plata | 0.001 |
| cobre | 0.1 | zinc | < 0.1 |
Silicio de grado metalúrgico (MGS)
El material fuente típico para la producción comercial de silicio elemental es la grava de cuarcita; una forma relativamente pura de arena (SiO 2). El primer paso en la síntesis de silicio es la fusión y reducción de la sílice en un horno de arco de electrodo sumergido. Un ejemplo del cual se muestra esquemáticamente en la Figura\(\PageIndex{1}\), junto con las reacciones químicas apropiadas. Una mezcla de grava de cuarcita y carbono se calientan a altas temperaturas (ca. 1800 °C) en el horno. El lecho de carbono consiste en una mezcla de carbón, coque y astillas de madera. Estos últimos aportando la porosidad necesaria para que los gases creados durante la reacción (SiO y CO) puedan fluir a través del lecho.

La reacción de reducción global de SiO 2 se expresa en (7.10.1), sin embargo, la secuencia de reacción es más compleja de lo que implica esta reacción global, e implica la formación de intermedios de SiC y SiO. La reacción inicial entre SiO 2 y C fundido, (7.10.2), tiene lugar en el arco entre electrodos adyacentes, donde la temperatura local puede superar los 2000 °C. El SiO y CO así generados fluyen a zonas más frías en el horno donde se forma SiC, (7.10.3), o superiores en el lecho donde reforman SiO 2 y C, (7.10.2). El SiC reacciona con SiO 2 fundido, (7.10.4), produciendo el silicio deseado junto con SiO y CO. El silicio fundido formado se extrae del horno y se solidifica.
\[ \text{SiO}_2\text{(liquid) + 2 C(solid)} \rightarrow \text{Si(liquid) + 2 CO(gas)}\]
\[ \text{SiO}_2\text{ + 2 C} \xrightleftharpoons[\text{<1600 °C}]{\text{>1700 °C}} \text{SiO + CO}\]
\[ \text{SiO + 2C} \rightarrow \text{SiC + CO (1600 - 1700 °C)}\]
\[ \text{SiC _ SiO}_2 \rightarrow \text{Si + SiO + CO}\]
El MGS tal como se produce es aproximadamente 98-99% puro, siendo las principales impurezas el aluminio y el hierro (Tabla\(\PageIndex{1}\)), sin embargo, la obtención de bajos niveles de impurezas de boro es de particular importancia, debido a que es difícil de eliminar y sirve como dopante para el silicio. Los inconvenientes del proceso anterior son que es intensivo en energía y materia prima. Se estima que la producción de una tonelada métrica (1,000 kg) de MGS requiere de 2500 a 2700 kg de cuarcita, 600 kg de carbón vegetal, 600 a 700 kg de carbón o coque, 300 a 500 kg de astillas de madera y 500,000 kWh de energía eléctrica. Actualmente, se producen aproximadamente 500,000 toneladas métricas de MGS por año, en todo el mundo. La mayor parte de la producción (aproximadamente 70%) se utiliza para aplicaciones metalúrgicas (por ejemplo, las aleaciones de aluminio-silicio se utilizan comúnmente para bloques de motores automotrices) de donde deriva su nombre. Las aplicaciones en una variedad de productos químicos como las resinas de silicona representan aproximadamente el 30%, y solo el 1% o menos de la producción total de MGS se utiliza en la fabricación de EGS de alta pureza para la industria electrónica. El consumo mundial actual de EGS es aproximadamente de 5 x 10 6 kg al año.
Silicio de grado electronico (EGS)
El silicio de grado electrónico (EGS) es un material policristalino de pureza excepcionalmente alta y es la materia prima para el crecimiento del silicio monocristalino. EGS es uno de los materiales más puros comúnmente disponibles, ver Tabla\(\PageIndex{2}\). La formación de EGS a partir de MGS se logra a través de procesos de purificación química. El concepto básico del cual implica la conversión de MGS en un compuesto de silicio volátil, el cual se purifica por destilación, y posteriormente se descompone para volver a formar silicio elemental de mayor pureza (es decir, EGS). Independientemente de la vía de purificación empleada, la primera etapa es la pulverización física de MGS seguida de su conversión a los compuestos volátiles de silicio.
Varios compuestos, como monosilano (SiH 4), diclorosilano (SiH 2 Cl 2), triclorosilano (SiHCl 3) y tetracloruro de silicio (SiCl 4), han sido considerados como intermedios químicos. Entre estos, el SiHCl 3 se ha utilizado predominantemente como compuesto intermedio para la posterior formación de EGS, aunque en menor medida se emplea SiH 4. El tetracloruro de silicio y sus derivados clorados inferiores se utilizan para el crecimiento por deposición química de vapor (CVD) de Si y SiO 2. Los puntos de ebullición del silano y sus productos clorados (Tabla\(\PageIndex{3}\)) son tales que se separan convenientemente entre sí por destilación fraccionada.
| Compuesto | Punto de ebullición (°C) |
| SiH 4 | -112.3 |
| SiH 3 Cl | -30.4 |
| SiH 2 Cl 2 | 8.3 |
| SiHCl 3 | 31.5 |
| SiCl 4 | 57.6 |
Las razones del uso predominante de SiHCl 3 en la síntesis de EGS son las siguientes:
- El SiHCl 3 se puede formar fácilmente mediante la reacción de cloruro de hidrógeno anhidro con MGS a temperaturas razonablemente bajas (200 - 400 °C);
- es líquido a temperatura ambiente para que la purificación se pueda lograr usando técnicas de destilación estándar;
- se maneja fácilmente y si está seco se puede almacenar en tanques de acero al carbono;
- su líquido se vaporiza fácilmente y, cuando se mezcla con hidrógeno, puede transportarse en líneas de acero sin corrosión;
- se puede reducir a presión atmosférica en presencia de hidrógeno;
- su deposición puede tener lugar sobre silicio calentado, eliminando así el contacto con cualquier superficie extraña que pueda contaminar el silicio resultante; y
- reacciona a temperaturas más bajas (1000 - 1200 °C) y a velocidades más rápidas que el SiCl 4.
Proceso de clorosilano (Seimens)
El triclorosilano se sintetiza calentando MGS en polvo con cloruro de hidrógeno anhidro (HCl) a alrededor de 300 °C en un reactor de lecho fluidizado, (7.10.5).
\[ \text{Si(solid_ + 3 HCl(gas)} \xrightleftharpoons[\text{>900 °C}]{\text{ca. 300 °C}} \text{SiHCl}_3\text{(vapor) + H}_2\text{(gas)}\]
Dado que la reacción es realmente un equilibrio y la formación de SiHCl 3 altamente exotérmica, la eliminación eficiente del calor generado es esencial para asegurar un rendimiento máximo de SiHCl 3. Si bien la reacción estequiométrica es la que se muestra en (7.10.5), en realidad se prepara una mezcla de silanos clorados los cuales deben ser separados por destilación fraccionada, junto con los cloruros de cualquier impureza. En particular, el hierro, el aluminio y el boro se eliminan como FeCl 3 (b.p. = 316 °C), AlCl 3 (m.p. = 190 °C subl.) y BCl 3 (b.p. = 12.65 °C), respectivamente. La destilación fraccionada de SiHCl 3 a partir de estos haluros de impurezas da como resultado una pureza mucho mayor con una concentración de impurezas eléctricamente activas de menos de 1 ppb.
EGS se prepara a partir de SiHCl 3 purificado en un proceso de deposición química de vapor (CVD) similar al crecimiento epitaxial de Si. El SiHCl 3 de alta pureza se vaporiza, se diluye con hidrógeno de alta pureza y se introduce en el reactor de deposición Seimens, mostrado esquemáticamente en la Figura\(\PageIndex{2}\). Dentro del reactor, varillas delgadas de silicio llamadas varillas delgadas (ca. 4 mm de diámetro) están soportadas por electrodos de grafito. El calentamiento por resistencia de las varillas delgadas provoca la descomposición del SiHCl 3 para producir silicio, como se describe por la reacción inversa mostrada en (7.10.5).

El cambio en el equilibrio de formar SiHCl 3 de Si a baja temperatura, a formar Si a partir de SiHCl 3 a alta temperatura es como consecuencia de la dependencia de la temperatura, (7.10.6), de la constante de equilibrio, (7.10.7) donde ρ = presión parcial, para (7.10.5). Dado que la formación de SiHCl 3 es exotérmica, es decir, ΔH < 0, un aumento en la temperatura provoca que disminuya la presión parcial de SiHCl 3. Por lo tanto, el proceso Siemens se realiza típicamente a aproximadamente 1100 °C, mientras que el proceso de lecho fluidizado inverso se lleva a cabo a 300 °C.
\[ \text{lnK}_{\text{p}} \text{ = } \dfrac{ \text{-}\Delta\text{H}}{\text{RT}}\]
\[ \text{K}_{\text{p}} \text{ = } \dfrac{^{\rho}\text{SiHCl}_3 \text{ } ^{\rho}\text{H}_2}{^{\rho}\text{HCl}}\]
Las varillas delgadas actúan como un punto de nucleación para la deposición de silicio, y la varilla policristalina resultante consiste en granos columnares de silicio (polisilicio) crecidos perpendiculares al eje de la varilla. El crecimiento ocurre a menos de 1 mm por hora, y después de la deposición durante 200 a 300 horas se producen barras de polisilicio de alta pureza (EGS) de 150 a 200 mm de diámetro. Para el posterior refinamiento de la zona de flotación, las varillas EGS de polisilicio se cortan en barras cilíndricas largas. Alternativamente, las barras de polisilicio conformadas se rompen en trozos para procesos de crecimiento monocristalino, por ejemplo, crecimiento en masa fundida de Czochralski.
Además de la formación de silicio, el coproducto HCl reacciona con el reactivo SiHCl 3 para formar tetracloruro de silicio (SiCl 4) e hidrógeno como subproductos principales del proceso, (7.10.8). Esta reacción representa una desventaja importante con el proceso Seimens: poca eficiencia del consumo de silicio y cloro. Típicamente, solo el 30% del silicio introducido en el reactor CVD se convierte en polisilicio de alta pureza.
\[ \text{HCl + SiHCl}_3 \rightarrow \text{SiCl}_4\text{ + H}_2 \]
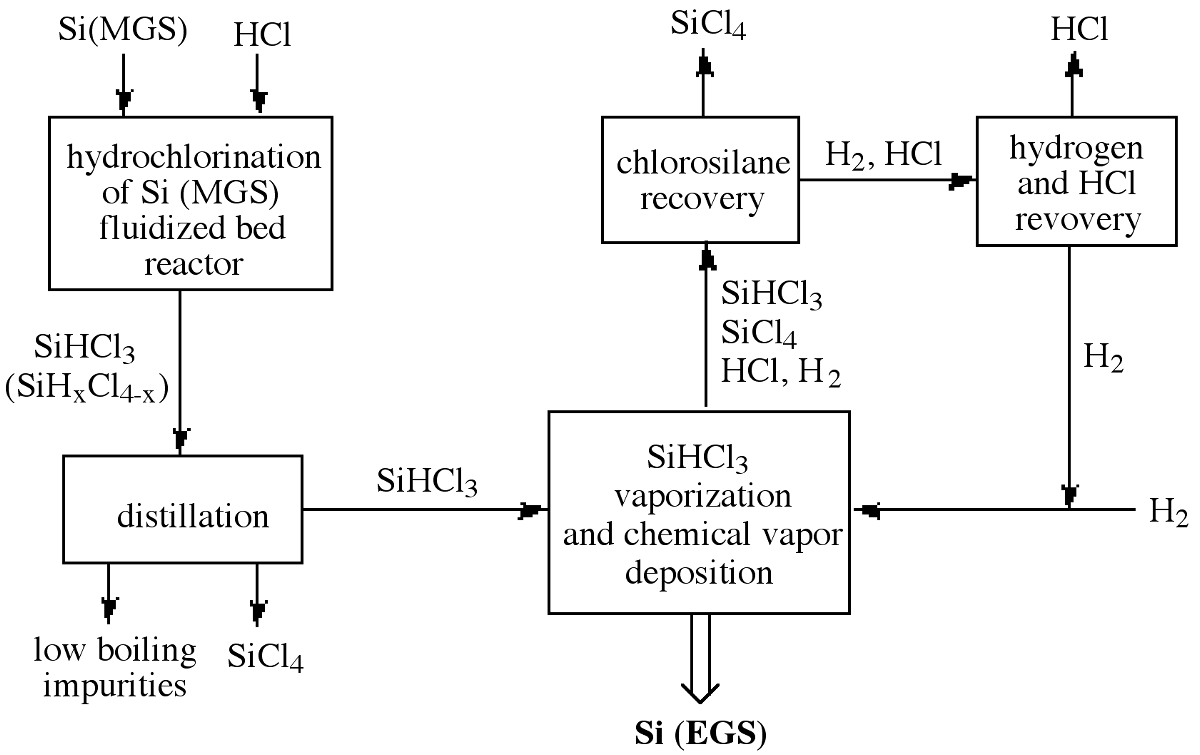
Con el fin de mejorar la eficiencia, el HCl, el SiCl 4, el H 2 y el SiHCl 3 sin reaccionar se separan y se recuperan para su reciclaje. La Figura\(\PageIndex{3}\) ilustra todo el proceso de clorosilano comenzando con MGS e incluyendo el reciclaje de los subproductos de reacción para lograr una alta eficiencia general del proceso. Como consecuencia, el costo de producción de EGS de alta pureza depende de la utilidad comercial del subproducto, SiCl 4. Las desventajas adicionales del proceso Seimens se derivan de su tamaño de lote relativamente pequeño, tasa de crecimiento lento y alto consumo de energía. Estos temas han llevado a la investigación de rutas alternativas rentables a EGS.
Proceso de silano
Un proceso alternativo para la producción de EGS que ha comenzado a recibir atención comercial es la pirólisis del silano (SiH 4). Las ventajas de producir EGS a partir de SiH 4 en lugar de SiHCl 3 son potencialmente menores costos asociados con temperaturas de reacción más bajas y subproductos menos dañinos. El silano se descompone < 900 °C para dar silicio e hidrógeno, (7.10.9).
\[\text{SiH}_4\text{(vapor)} \rightarrow \text{Si(solid) + 2 H}_2\text{(gas)}\]
El silano se puede preparar por varias rutas, cada una de las cuales tiene ventajas con respecto a la pureza y el costo de producción. El proceso más simple implica la reacción directa de polvos de MGS con magnesio a 500 °C en una atmósfera de hidrógeno, para formar siliciuro de magnesio (Mg 2 Si). El siliciuro de magnesio se hace reaccionar luego con cloruro de amonio en amoníaco líquido por debajo de 0 °C, (7.10.10).
\[ \text{Mg}_2\text{Si + 4 NH}_4\text{Cl} \rightarrow \text{SiH}_4\text{ + 2 MgCl}_2\text{ + 5 NH}_3\]
Este proceso es ideal para la eliminación de impurezas de boro (un dopante tipo p en Si), ya que el diborano (B 2 H 6) producido durante la reacción forma el complejo ácido-base de Lewis, H 3 B (NH 3), cuya volatilidad es suficientemente inferior a SiH 4, permitiendo la purificación de este último. Es posible preparar EGS con un contenido de boro ≤ 20 ppt utilizando SiH 4 sintetizado de esta manera. Sin embargo, el fósforo (otro dopante) en forma de PH 3 puede estar presente como contaminante que requiere purificación posterior del SiH 4.
Las rutas alternativas al SiH 4 implican la reducción química del SiCl 4 por hidruro de litio, (7.10.11), hidruro de litio y aluminio, (7.10.12), o vía hidrogenación en presencia de silicio elemental, (7.10.13) - (7.10.16). Las reacciones de reducción de hidruro se pueden llevar a cabo en escalas relativamente grandes (ca. 50 kg), pero solo en procesos discontinuos. En contraste, Union Carbide ha adaptado la hidrogenación a un proceso continuo, implicando reacciones de desproporción de clorosilanos, (7.10.14) - (7.10.16), y la destilación fraccionada de silano, Tabla\(\PageIndex{3}\).
\[ \text{SiCl}_4\text{ + LiH} \rightarrow \text{SiH}_4\text{ + 4 LiCl} \]
\[ \text{SiCl}_4\text{ + LiAlH}_4 \rightarrow \text {SiH}_4 \text{ + LiCl + AlCl}_4\]
\[ \text{SiCl}_4\text{ + 2 H}_2\text{ + Si(98%)} \rightarrow \text{4 SiHCl}_3 \]
\[ \text{2 SiHCl}_3 \rightarrow \text{SiH}_2\text{Cl}_2\text{ + 2 SiHCl}_3\]
\[ \text{3 SiH}_2\text{Cl}_2 \rightarrow \text{SiH}_2\text{Cl + 2 SiHCl}_3 \]
\[ \text{2 SiH}_3\text{Cl} \rightarrow \text{SiH}_4\text{ + SiH}_2\text{Cl}_2\]
La pirólisis de silano sobre filamentos de polisilicio calentados resistivamente a 700 - 800 °C produce EGS policristalinos. Como se señaló anteriormente, el EGS formado tiene impurezas de boro notablemente bajas en comparación con el material preparado a partir de triclorosilano. Además, el EGS resultante está menos contaminado con metales de transición del recipiente del reactor porque la descomposición del SiH 4 no causa tanto problema de corrosión como se observa con los compuestos precursores de haluro.
Deposición granular de polisilicio
Tanto los procesos de clorosilano (Seimens) como de silano dan como resultado la formación de varillas de EGS. Sin embargo, ha aumentado el interés en la formación de EGS policristalinos granulares. Este proceso fue desarrollado en la década de 1980, y se basa en la descomposición de SiH 4 en un reactor de deposición de lecho fluidizado para producir polisilicio granular de flujo libre.
Las partículas diminutas de silicio se fluidizan en un flujo de SiH 4 /H 2 y actúan como cristales de siembra sobre los que se deposita polisilicio para formar partículas esféricas de flujo libre. La distribución de tamaño de las partículas así formadas está en el rango de 0.1 a 1.5 mm de diámetro con un tamaño promedio de partícula de 0.7 mm. Las partículas de semilla de lecho fluidizado se fabrican originalmente moliendo EGS en un molino de bolas (o martillo) y lixiviando el producto con ácido, peróxido de hidrógeno y agua. Este proceso requiere mucho tiempo y es costoso, y tiende a introducir impurezas indeseables de las amoladoras de metal. En un nuevo método, las partículas grandes de EGS se disparan entre sí mediante una corriente de gas inerte de alta velocidad y la colisión las descompone en partículas de tamaño adecuado para un lecho fluidizado. Este proceso tiene la principal ventaja de que no introduce materiales extraños y no requiere lixiviación u otra purificación posterior.
Los reactores de lecho fluidizado son mucho más eficientes que los reactores de varilla tradicionales como consecuencia de la mayor superficie disponible durante el crecimiento CVD del silicio. Se ha sugerido que los reactores de lecho fluidizado requieren de 1/5 a 1/10 la energía, y la mitad del costo de capital del proceso tradicional. La calidad del polisilicio de lecho fluidizado ha demostrado ser equivalente a la del polisilicio producido por los métodos convencionales. Además, EGS granular en forma de flujo libre, y con alta densidad aparente, permite a los cultivadores de cristales obtener los altos rendimientos de producción reproducibles de cada ciclo de crecimiento cristalino. Por ejemplo, en el proceso de crecimiento de cristales de Czochralski, los crisoles se pueden llenar rápida y fácilmente hasta una carga uniforme con EGS granulares, que generalmente exceden los de los trozos de polisilicio apilados aleatoriamente producidos por el proceso de silano Siemens.
Zona de refinación
La técnica de refinación de zona se utiliza para purificar materiales sólidos y se emplea comúnmente en el refinado metalúrgico. En el caso del silicio se puede utilizar para obtener la pureza final deseada de EGS, la cual ya ha sido purificada por procesos químicos. La refinación de zona fue inventada por Pfann, y hace uso del hecho de que la solubilidad en equilibrio de cualquier impureza (por ejemplo, Al) es diferente en las fases sólida y líquida de un material (por ejemplo, Si). Para las soluciones diluidas, como se observa en el silicio EGS, un coeficiente de segregación en equilibrio (k 0) se define por k 0 = C s/C l, donde C s y Cl son las concentraciones de equilibrio de la impureza en el sólido y líquido cerca del interfaz, respectivamente.
Si k 0 es menor que 1 entonces las impurezas se dejan en la masa fundida a medida que la zona fundida se mueve a lo largo del material. En un sentido práctico se establece una zona fundida en una varilla sólida. La zona se mueve luego a lo largo de la varilla de izquierda a derecha. Si k 0 < 1 entonces la parte congelada que queda en el borde de salida de la zona fundida móvil será más pura que el material que se funde en el borde de ataque del lado derecho de la zona fundida en movimiento. En consecuencia, el sólido a la izquierda de la zona fundida es más puro que el sólido de la derecha. Al finalizar el primer paso las impurezas se concentran a la derecha de la muestra sólida. La repetición del proceso permite la purificación a niveles excepcionalmente altos. En la tabla se\(\PageIndex{4}\) enumeran los coeficientes de segregación de equilibrio para impurezas comunes y elementos dopantes en silicio; cabe señalar que todos son menores de 1.
| Element | k 0 | Element | k 0 |
| aluminio | 0.002 | hierro | 8 x 10 -6 |
| boro | 0.8 | oxígeno | 0.25 |
| carbono | 0.07 | fósforo | 0.35 |
| cobre | 4 x 10 -6 | antimonio | 0.023 |
Bibliografía
- K. G. Baraclough, K. G., en La química de la industria de semiconductores, Eds. S. J. Moss y A. Ledwith, Blackie and Sons, Glasgow, Escocia (1987).
- L. D. Crossman y J. A. Baker, Semiconductor Silicon 1977, Electrochem. Soc., Princeton, Nueva Jersey (1977).
- W. C. O'Mara, Ed. Manual de Tecnología de Silicio Semiconductor, Noyes Pub., Nueva Jersey (1990).
- W. G. Pfann, Zone Melting, John Wiley & Sons, Nueva York, (1966).
- F. Shimura, Semiconductor Silicon Crystal Technology, Academic Press (1989).

