2.2: Partículas subatómicas y una visión moderna de un átomo
( \newcommand{\kernel}{\mathrm{null}\,}\)
Los átomos están compuestos por partículas subatómicas fundamentales: electrones, protones y neutrones.
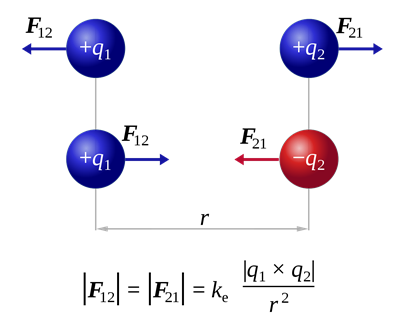
El electrón fue la primera partícula subatómica descubierta. El descubrimiento de electrones está relacionado con el estudio de los rayos catódicos y el conocimiento básico de las cargas, es decir, hay dos tipos de cargas +ve y —ve; como las cargas se repelen entre sí; las cargas opuestas se atraen entre sí como se ilustra en la Fig. 2.2.1; el campo eléctrico y magnético desvía las cargas móviles.
El descubrimiento del electrón
Rayos catódicos
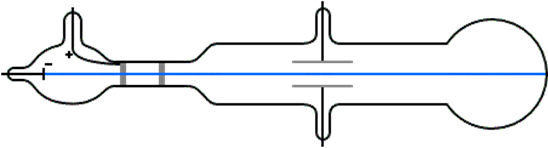
Los rayos catódicos son un tipo de radiación emitida desde un cátodo (electrodo cargado negativamente) cuando se aplica un campo eléctrico alto a través de un par de electrodos bajo condiciones de presión reducida, como se ilustra en la Fig. 2.2.2. Los rayos catódicos viajan en el espacio entre electrodos. Si hay un agujero en el ánodo, los rayos catódicos pueden pasar a través del orificio y seguir moviéndose en un camino recto. Los rayos catódicos emiten luz cuando golpean una pantalla fluorescente.
Los experimentos de J.J Thomson: el descubrimiento de electrones
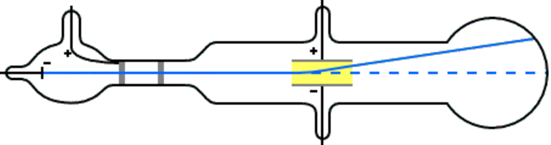
J.J. Thomson estudió los rayos catódicos y encontró que un campo eléctrico desvía los rayos catódicos hacia el electrodo positivo. Esta observación indica que los rayos catódicos fueron cargas negativas. Al cambiar el material catódico no se modificaron las propiedades de los rayos catódicos. J.J. Thomson concluyó a partir de estas observaciones que los rayos catódicos eran corrientes de partículas, llamadas electrones, que están presentes en los átomos de todos los elementos.
Otros descubrimientos revelaron que la carga en los electrones es de 1.602 x 10 -19 C, y su masa es de 9.10 x 10 -28 g Los electrones son increíblemente ligeros, aproximadamente dos mil veces más ligeros que el átomo más ligero.
Modelo de pudín de ciruela de un átomo
Con base en la información de experimentos de rayos catódicos, J.J. Thomson concluyó que hay —ve electrones de carga y una materia +ve que representa casi toda la masa del átomo. Propuso el modelo de átomos de ciruela-pudín, es decir, la materia positiva es como una nube difusa o gelatina que ocupa el espacio del átomo, y los electrones están incrustados en él como frutas en gelatina en el caso del plato de postre de ciruela-pudín como se muestra en la Fig. 2.2.3.

El descubrimiento del núcleo de un átomo
α-Rayos
α-Los rayos, pronunciados como rayos alfa, son radiaciones de alta energía emitidas por algunas fuentes radiactivas. Losα rayos están compuestos porα partículas que son átomos de helio sin electrones.
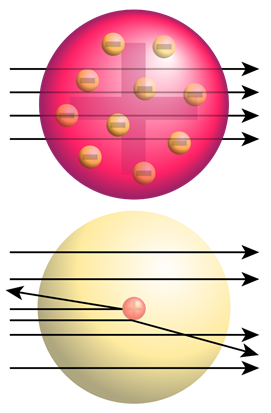
Experimento de lámina de oro de Rutherford: el descubrimiento del núcleo
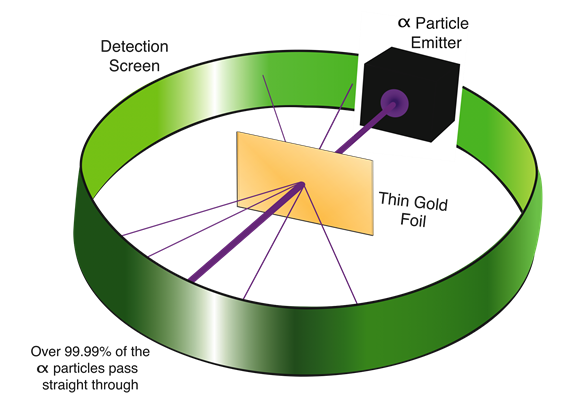
Rutherford probó el modelo de pudín de ciruela del átomoα bombardeando rayos sobre una fina lámina de oro. Esperaba queα -partículas pasaran a través de la lámina de oro sin desviarse como balas disparadas a través de una lámina de espuma de poliestireno. Observó que aunque la mayoría de lasα partículas pasaban a través de la lámina de oro sin desviarse, una en ~20,000 se desviaba en ángulos mayores, como se ilustra en la Fig. 2.2.4.
Dado que el modelo de ciruela-pudín de un átomo no podía explicar la desviación deα las partículas, Rutherford concluyó que había una región diminuta pero muy densa en el centro de un átomo, ahora llamada núcleo, que desviabaα las partículas. El experimento de lámina de oro de Rutherford condujo al descubrimiento del núcleo.
El descubrimiento del protón
Rutherford predijo que una partícula fundamental de átomos cargada positivamente debería residir en el núcleo. Posteriormente, Rutherford observó queα los rayos brillantes sobre el gas nitrógeno producían partículas cargadas positivamente llamadas protones. Los protones son aproximadamente 20,000 veces más pesados que los electrones pero llevan una carga +ve igual en magnitud a la carga —ve en un electrón.
El descubrimiento del neutrón
La masa de protones y electrones no dio cuenta de la masa global de un átomo, lo que llevó a la búsqueda de otra partícula subatómica. James Chadwick descubrió que bombardearα rayos sobre un objetivo de berilio producía una radiación altamente penetrante consistente en un haz de partículas neutras, ahora llamadas neutrones. La presencia de neutrones en el núcleo explica la falta de masa de átomos.
Se han descubierto otras partículas subatómicas, por ejemplo, quarks que constituyen protones y neutrones, pero su conocimiento no es crítico para comprender la química básica.
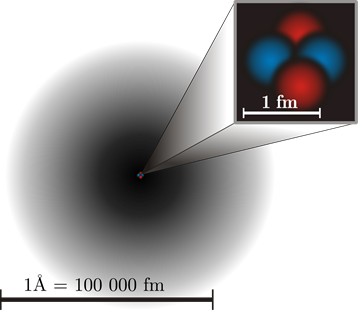
Vista moderna de un átomo
Los protones y neutrones residen en el núcleo con un diámetro de 10 -15 m. Los electrones ocupan la región fuera del núcleo con un diámetro de 10 -10 m, como se ilustra en la Fig. 2.2.5. Si el núcleo es aproximadamente del tamaño de una canica, el átomo sería aproximadamente del tamaño de una cancha de fútbol.
Propiedades de las partículas subatómicas
Las unidades SI básicas de masa, carga eléctrica y distancia son demasiado grandes para mediciones a escala atómica. Para ello se definen nuevas unidades, es decir:
Unidad de masa atómica (amu) que es 1/12 de la masa de un solo átomo de carbono que tiene 6 protones y 6 neutrones en él.
1 amu=1.660539606660(50)×10−27 kg
La carga en uno electrones es la carga de electrones (e). 1 e=1.602176634×10−19 C
1 Å = 10 -10 m
Estas unidades se utilizan generalmente para masas, cargas y diámetros de átomos. En el Cuadro 1 se enumeran las propiedades básicas de las partículas subatómicas.
|
Partícula |
Cargo (e) |
Masa (amu) |
|---|---|---|
|
Protón |
+1 |
1.0073 |
|
Neutrón |
0 |
1.0078 |
|
Electron |
-1 |
5.486 x 10 -4 |
Cómo se mantienen las partículas subatómicas en el átomo
La fuerza gravitacional es insignificante en el caso del comportamiento de las partículas subatómicas en los átomos. Aunque los electrones repelen a otros electrones, permanecen en un espacio minúsculo debido a la atracción hacia el núcleo. De igual manera, los protones se repelen entre sí, pero la fuerza eléctrica es pequeña en comparación con la fuerte fuerza nuclear que mantiene juntos protones y neutrones en el núcleo.


