2.3: Átomos de los elementos
( \newcommand{\kernel}{\mathrm{null}\,}\)
Símbolo de un elemento
Los elementos están representados por símbolos, el primer alfabeto de su nombre inglés o no inglés, escritos en mayúsculas. Por ejemplo, C para carbono, N para nitrógeno y I para yodo. Por lo general, otro alfabeto también se elige del nombre del elemento y se escribe como letra pequeña, por ejemplo, Al para aluminio, Zn para zinc y Ca para calcio. Algunos símbolos de elementos se derivan de nombres no ingleses, por ejemplo, Na para sodio del nombre latino natium, Cu para cobre del latín cupurum y Ag para plata del latín argentum.
Los átomos del mismo elemento tienen el mismo número de protones, y los átomos de diferentes elementos tienen diferentes números de protones. En otras palabras, el número de protones en un átomo define el elemento. Se conocen 118 elementos en este momento; el número de protones en los átomos varía de 1 para hidrógeno a 118 para Oganesson (Og).
El número de protones en un átomo se llama el número atómico.
El número atómico define el elemento. Un subíndice a la izquierda del símbolo de un elemento representa el número atómico. Por ejemplo,H1 muestra un protón en un átomo de hidrógeno, yC6 muestra 6 protones en un átomo de carbono.
El número de protones más el número de neutrones en un átomo es el número de masa.
Un superíndice a la izquierda del símbolo de un elemento representa el número de masa. Por ejemplo,H11 es un átomo de hidrógeno con número atómico 1, número de masa 1, y sin neutrones, mientras queF199 es un átomo de flúor con 9 protones y 10 neutrones.
El número de electrones en un átomo es igual al número de protones menos la carga en el átomo.
El número de electrones es igual al número de protones en el caso de un átomo neutro, ya que no hay carga sobre un átomo neutro.
Un átomo neutro puede perder algunos electrones y convertirse en una partícula cargada positivamente, llamada catión.
La carga se representa como un superíndice en el lado derecho del símbolo del elemento, por ejemplo,H+11 es hidrógeno sin ningún electrón, es decir, 1 protón, 0 neutrones y 0 electrones. Ca2+2040es calcio con dos electrones menos que los protones, es decir, 20 protones, 20 neutrones y 18 electrones.
Un átomo puede ganar electrones y convertirse en una partícula cargada negativamente, llamada anión.
Por ejemplo,O2−168 es oxígeno con dos electrones más que protones sobre él, es decir, 8 protones, 8 neutrones y 10 electrones. AF−199 es flúor con un electrón más que protones sobre él, es decir, 9 protones, 10 neutrones y 10 electrones. La Fig. 2.3.1 ilustra la ganancia o pérdida de electrones de átomos neutros.
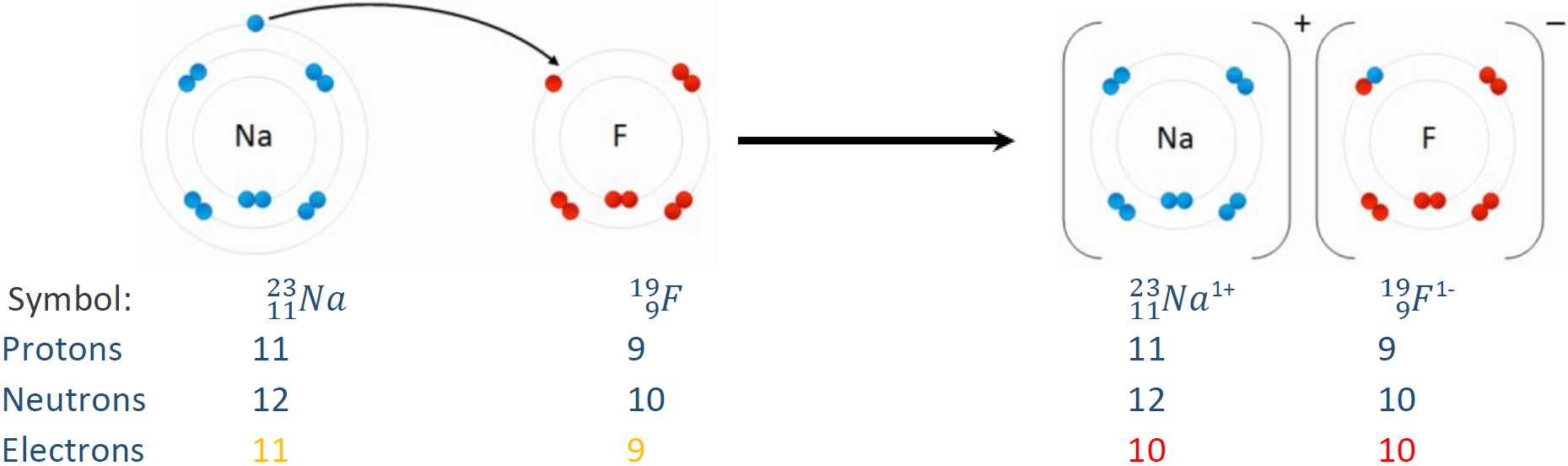
Cálculo del número de protones, neutrones y electrones
En general, un átomo de un elemento hipotético X se representa comoAZXI charge donde Z es el número atómico, A es el número de masa, e I es un número entero igual al número de carga y carga el signo del número de carga: + o -.El número de protones, neutrones, y los electrones se calcula utilizando las siguientes fórmulas:
Número de protones = A,
Número de neutrones = A — Z, y
Número de electrones = Z — (carga I),
donde un cargo es un signo + o - del número de cargo.
Calcular el número de protones, neutrones y electrones enO168,O2−168, yO+168?
Solución
O168: número de protones = Z = 8, número de neutrones = A — Z = 16-8 = 8,
y número de electrones = Z — (carga I) = 8 — 0 = 8.
O2−168: número de protones = Z = 8, número de neutrones = A — Z = 16-8 = 8,
y número de electrones = Z — (carga I) = 8 — (-2) = 8 + 2 = 10.
O1+168: número de protones = Z = 8, número de neutrones = A — Z = 16-8 = 8,
y número de electrones = Z — (carga I) = 8 — (+1) = 8 — 1 = 9.
Si el número de cargo I es de 1 enAZXI charge, generalmente no se escribe, sino que se escribe un número más de uno. Por ejemplo,O−168 tiene cambio = -1,O2−168 tiene carga de carga -2, yO+168 tiene cargo = +1.
Isótopos
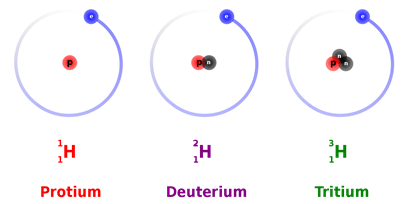
Todos los átomos del mismo elemento tienen el mismo número de protones pero pueden tener un número diferente de neutrones. Por ejemplo,H11,H21, yH31 tienen neutrones iguales a 0, 1, y 2, respectivamente.
Los átomos del mismo elemento que tienen un número diferente de neutrones se denominan isótopos.
Por ejemplo,H11,H21, yH31 son isótopos de hidrógeno ilustrados en la Fig. 2.3.2. Otro ejemplo esLi63, yLi73 son dos isótopos de litio. Las muestras naturales de elementos suelen tener relaciones casi constantes de isótopos. En el Cuadro 1 se enumeran algunos isótopos de elementos y su porcentaje de abundancia en muestras naturales típicas.
|
Element |
Isótopos |
Abundancia (%) |
|---|---|---|
|
Hidrógeno |
H11 H21 H31 |
99.99 0.01 Despreciable |
|
Litio |
Li63 Li73 |
7.6 92.4 |
|
Carbono |
C126 C136 C146 |
98.93 1.07 Despreciable |
|
Cloro |
Cl3517 Cl3717 |
75.78 24.22 |
|
Bromo |
Br7935 Br8135 |
50.69 49.31 |
|
Uranio |
U23592 U23892 |
0.72 99.28 |
Masa atómica
La masa atómica listada en la tabla periódica es el promedio ponderado de las masas de los isótopos presentes en una muestra natural del elemento.
La siguiente fórmula calcula la masa atómica:
Atomic mass =∑[( mass of isotope )×( fractional abuncance of the isotope )
, donde∑ significa la suma de todos los isótopos del elemento, la abundancia fraccional del isótopo es el% de abundancia dividido por 100. La Fig. 2.3.3. ilustra cómo se enumera la masa atómica en una tabla periódica.
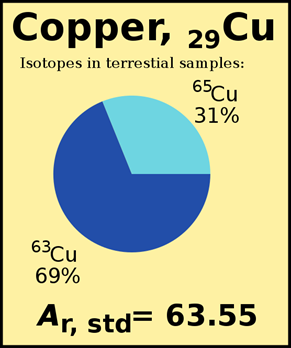
Calcular la masa atómica de cloro con dos isótopos en muestras naturales, es decir,Cl3517 de masa 34.969 amu y% de abundancia 75.78% yCl3717 de masa 36.996 amu y% abundancia 24.22%.
Solución
Fórmula: Atomic mass =∑[( mass of isotope )×( fractional abuncance of the isotope )
Conecte los valores dados en la fórmula y calcule:
(34.969 amu×75.78100)+(36.996 amu×24.22100)=35.45 amu
- Las masas atómicas de isótopos son cercanas pero no iguales a sus números de masa. Por ejemplo,Cl3517 tiene número de masa masa = 35, pero la masa atómica de este isótopo es 34.969 amu como se muestra en el ejemplo anterior.
- La masa atómica promedio ponderada suele estar más cerca del número de masa del isótopo más abundante, por ejemplo, 35.45 amu en el ejemplo anterior está cerca del número de masa 35 delCl3517 isótopo, que es el isótopo más abundante.
- La tabla periódica reporta la masa atómica calculada en el ejemplo anterior, es decir, el promedio ponderado de las masas de los isótopos presentes en la muestra natural del elemento.


