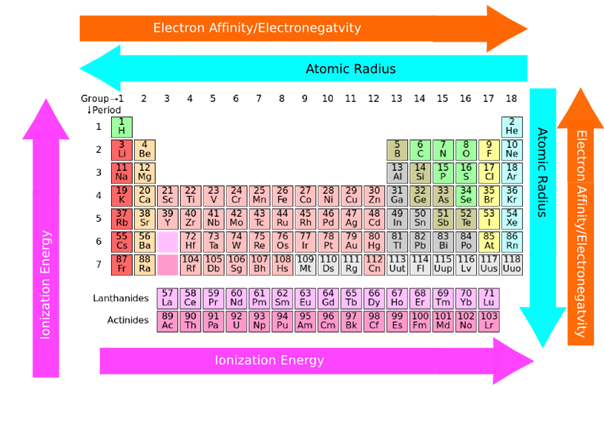
2.6: Las tendencias periódicas en las propiedades de los elementos
( \newcommand{\kernel}{\mathrm{null}\,}\)
Las propiedades de los elementos generalmente muestran una tendencia periódica que se correlaciona con su posición en la tabla periódica. A continuación se describen las propiedades y sus tendencias periódicas.
Electrones de valencia
Los electrones en la capa más externa son los electrones de valencia. La Fig. 2.5.8 muestra los electrones de valencia de los primeros veinte elementos en fuentes rojas.
Todos los elementos de un grupo tienen el mismo número de electrones de valencia igual al primer dígito de su número de grupo. Por ejemplo, el 1er grupo de hidrógeno y metales alcalinos tiene un electrón de valencia, el 2do grupo de metales alcalinos tiene dos electrones de valencia, los halógenos en el grupo 17 tienen siete electrones de valencia y los gases nobles en el grupo 18 tienen ocho electrones de valencia.
Los metales de transición en los grupos 3 a 12, y los metales de transición interna, es decir, lantanoides y actinoides -las dos filas de elementos colocadas debajo de la tabla periódica, son la excepción a la tendencia general de los electrones de valencia descrita anteriormente. Las configuraciones de electrones de valencia de metales de transición y metales de transición interna no se describen aquí; está fuera del alcance de este libro.
Los electrones de valencia determinan principalmente las propiedades químicas de los elementos. Los elementos del mismo grupo tienen propiedades químicas similares debido a que tienen la misma configuración de electrones de concha de valencia. Los elementos en una fila muestran un cambio gradual en las propiedades químicas debido a que su configuración electrónica de concha de valencia cambia gradualmente a lo largo de la fila.
Símbolos de Lewis
- Los símbolos de Lewis muestran los electrones de valencia como puntos alrededor del símbolo de un elemento. Un punto representa un electrón de valencia, por ejemplo,
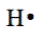 .
. - Los puntos se muestran en cualquiera de los cuatro lados del símbolo.
- Un solo punto en la parte superior, inferior, izquierda o derecha se muestran cuatro electrones de valencia. Después comienza a emparejar los puntos más allá de cuatro electrones de valencia, como se muestra en la Fig. 2.6.1 para los primeros veinte elementos.
- El helio es una excepción que tiene sólo dos electrones de valencia, pero se muestran emparejados.
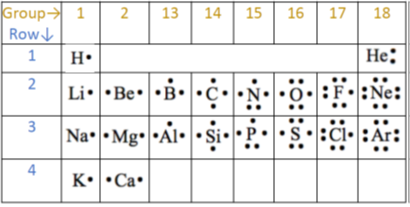
Los puntos de electrones en la estructura de Lewis son una manera conveniente de determinar cuántos enlaces puede hacer un átomo de un elemento.
Generalmente, cada punto desapareado puede hacer un enlace.
Por ejemplo, un átomo de hidrógeno con un punto no ventilado puede formar un enlace como en H-H. Un enlace está representado por una línea entre los átomos unidos. Un enlace se forma compartiendo electrones de valencia desapareados. Se le llama enlace covalente. El carbono, el nitrógeno, el oxígeno y el flúor con 4, 3, 2 y 1 punto desapareado pueden formar 4, 3, 2 y 1 enlace, por ejemplo, en las siguientes moléculas: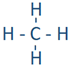 ,
,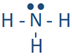 ,
,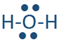 , y
, y .
.
- Cada línea en estas moléculas representa un par de electrones de enlace, y
- el par de puntos representan electrones de valencia que no están involucrados en la unión, llamados pares solitarios de electrones.
Tamaño atómico
Los electrones existen alrededor del núcleo en una apariencia de nube sin límites claramente definidos. Por lo tanto, el tamaño atómico generalmente se refiere al radio covalente de un átomo que es la mitad de la distancia entre los núcleos unidos covalentemente en una molécula homonuclear, como Cl 2, I2, H2, como se ilustra en la Fig. 2.6.2.
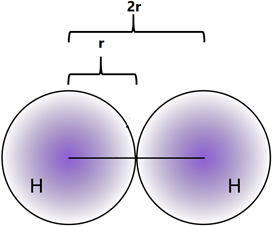
- El tamaño atómico generalmente aumenta de arriba a abajo en un grupo porque los electrones de valencia se suman en la capa superior en cada miembro consecutivo de un grupo abajo de la columna.
- El tamaño atómico generalmente disminuye de izquierda a derecha en una fila debido a que los electrones de valencia están en la misma cáscara mientras que más protones se suman al núcleo, aumentando la atracción sobre los electrones de valencia, como se ilustra en la Fig. 2.6.3.
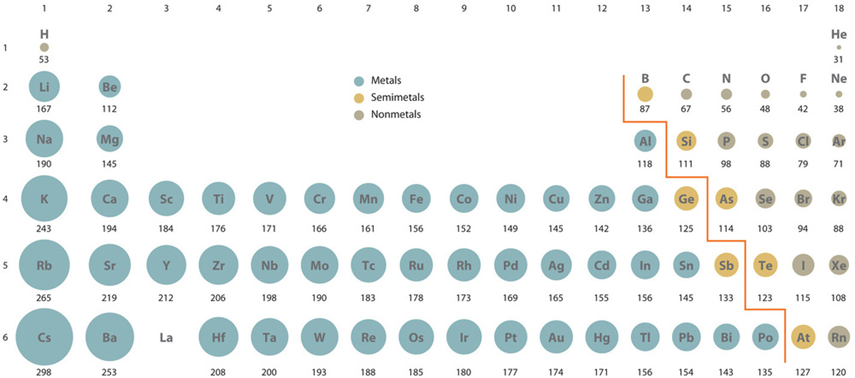
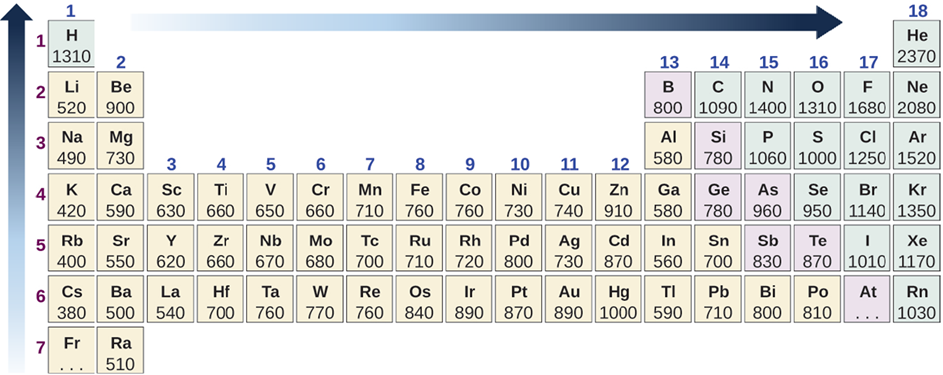
Energía de ionización
El núcleo cargado positivamente atrae a los electrones cargados negativamente. Por lo tanto, la eliminación de un electrón del átomo requiere energía. La ionización produce un catión con menos electrones que el átomo neutro parental, es decir, cationes.
La energía de ionización es la energía necesaria para eliminar un electrón de un átomo neutro, como en la siguiente reacción.
Na+ ionization energy →Na1++e−
- La energía de ionización generalmente disminuye de arriba a abajo en una columna porque los electrones de valencia están más lejos y experimentan menos tracción hacia el núcleo hacia abajo de la columna.
- La energía de ionización generalmente aumenta de izquierda a derecha en una fila debido a que los electrones de valencia están en la misma capa mientras que más protones se suman al núcleo, lo que aumenta la atracción sobre los electrones de valencia.
La Fig. 2.6.4 ilustra la tendencia periódica en la energía de ionización.
Electronegatividad
La electronegatividad es la capacidad de un átomo en un compuesto para atraer el par de electrones de enlace hacia sí mismo. La electropositividad es lo opuesto a la electronegatividad. La electronegatividad es una propiedad de un átomo en un compuesto, es decir, un átomo unido, no una característica de un átomo individual.
Existen varias escalas de electronegatividad. La más utilizada es la escala de electronegatividad Pauling. La Fig. 2.6.5 muestra los valores de electronegatividades en la escala de electronegatividad de Pauling.
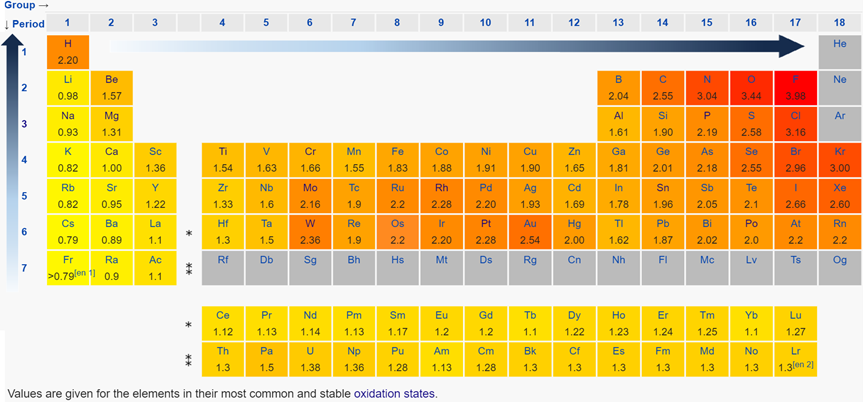
- La electronegatividad generalmente disminuye de arriba a abajo en una columna debido a que el tamaño atómico aumenta en la columna haciendo que el núcleo sea menos efectivo para tirar de los electrones de unión.
- El electronegativo generalmente aumenta de izquierda a derecha en una fila debido a que el tamaño atómico disminuye de izquierda a derecha en una fila, haciendo que el núcleo sea más efectivo para tirar del par de electrones de unión hacia sí mismo.
Carácter metálico
El carácter metálico se relaciona con la facilidad de perder un electrón en una reacción química. La tendencia del carácter metálico es opuesta a la tendencia de la energía de ionización.
- El carácter metálico generalmente aumenta de arriba a abajo en una columna debido a que el tamaño atómico aumenta hacia abajo de la columna, haciendo que los electrones de valencia sean menos apretados y más fáciles de eliminar.
- El carácter metálico generalmente disminuye de izquierda a derecha en una fila debido a que el tamaño atómico disminuye de izquierda a derecha, haciendo que los electrones de valencia sean más apretados y difíciles de eliminar.
Resumen de las tendencias periódicas
La energía de ionización y la electronegatividad generalmente aumentan de izquierda a derecha en una fila y de abajo hacia arriba en una columna. El tamaño atómico y el carácter metálico son opuestos, es decir, aumentan de derecha a izquierda en fila y de arriba a abajo en una columna. La Fig. 2.6.6 resume la tendencia periódica en las propiedades de los elementos.