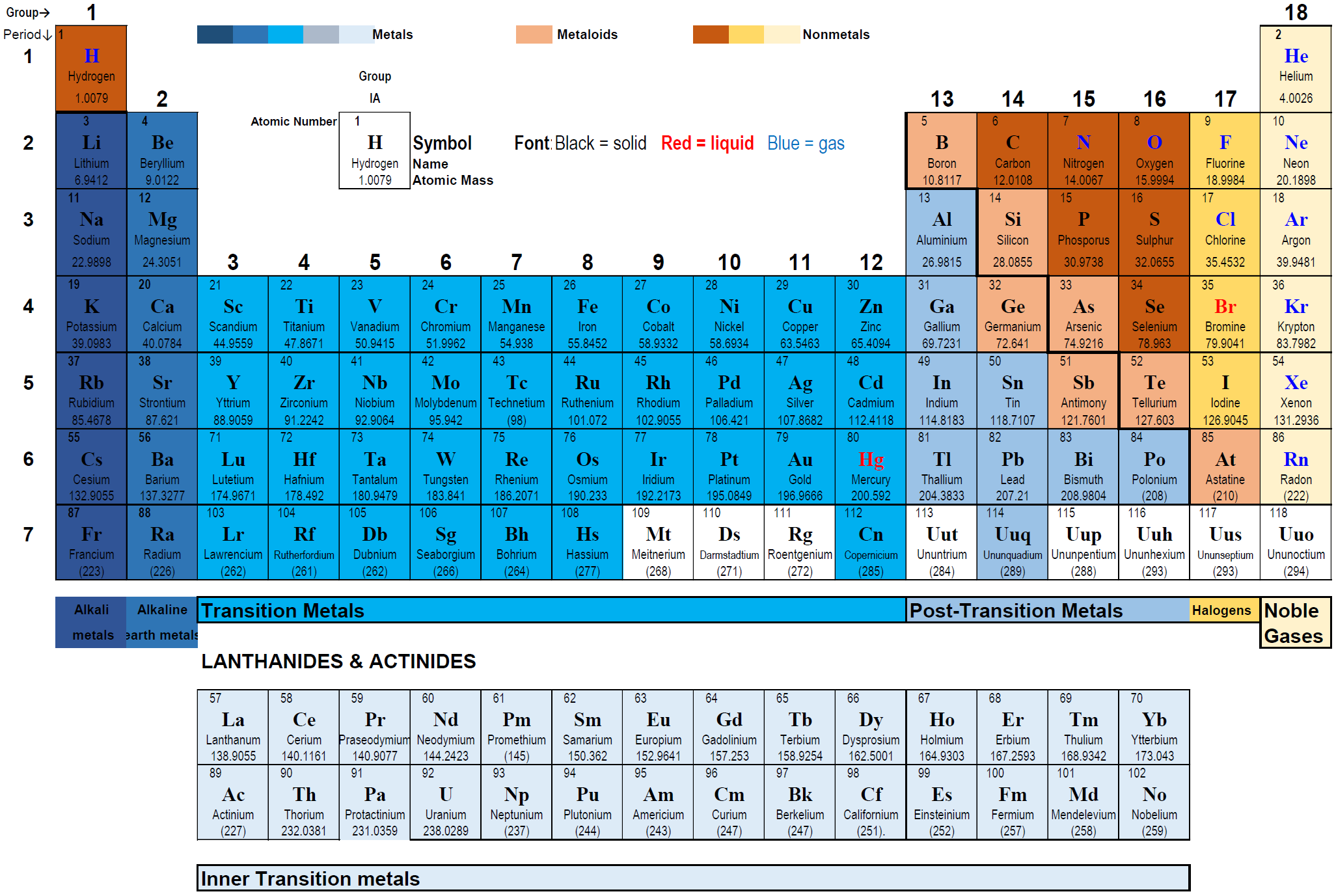
2.4: La tabla periódica
( \newcommand{\kernel}{\mathrm{null}\,}\)
Desarrollos tempranos
Los descubrimientos de elementos sucedieron a lo largo de mucho tiempo. A medida que crecía la lista de elementos conocidos, los científicos intentaron organizarlos en función de sus propiedades. Mendeleev organizó elementos en una tabla basada en masas atómicas. Se tradujo en elementos que tenían propiedades similares colocados uno al lado del otro en la mayoría de los casos. Hubo brechas intencionalmente dejadas en la tabla para los elementos que se predijeron con base en el conocimiento de la tabla periódica pero aún no descubiertos.
Se observaron pocas excepciones donde las propiedades de los elementos no coincidieron con el grupo en el que fueron colocados en base a sus masas atómicas. Mosely desarrolló un método para medir números atómicos basado en espectroscopía de rayos X. La disposición de los elementos basada en el número atómico en lugar de las masas atómicas eliminó las discrepancias en la tabla periódica de Mendeleev.
La moderna tabla periódica de elementos
- La tabla periódica moderna de elementos organiza los elementos según el orden creciente del número atómico comenzando desde el número atómico 1 para H y terminando con el número atómico 118 para Og, como se muestra en la Fig. 2.4.1.
- Los elementos están dispuestos en filas horizontales llamadas periodos y columnas verticales llamadas grupos.
Períodos
La tabla periódica tiene siete filas horizontales llamadas periodos. Los periodos están numerados: 1 en la parte superior a 7 en la parte inferior.
- El primer periodo tiene solo dos elementos: hidrógeno en el grupo 1 y helio en el grupo 18, con un hueco del grupo 2 al grupo 17.
- Los periodos 2 y 3 tienen ocho elementos cada uno, llenando los grupos 1 y 2 seguidos de los grupos 13 a 18, dejando un hueco del grupo 3 al grupo 12.
- Los periodos 4º y 5º tienen dieciocho elementos que se llenan sucesivamente del grupo 1 al grupo 18.
- Los periodos 6 y 7 tienen 32 elementos, cada uno: los dos primeros en los grupos 1 y 2, los siguientes catorce elementos en filas separadas debajo de la tabla. Estas dos filas de 14 elementos cada una se llaman Actínidos y Lantanoides, respectivamente. Después los siguientes dieciséis elementos llenan los grupos 3 a 18.
Grupos
La tabla periódica tiene 18 columnas verticales llamadas grupos o familias. Los grupos se adormecen a partir de 1 en el extremo izquierdo y pasando por 18 en el extremo derecho.
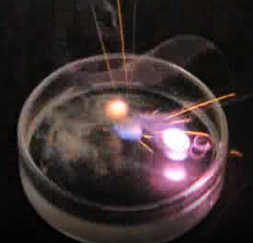
El primer grupo se llama metales alcalinos. Los metales alcalinos incluyen litio (Li), sodio (Na), potasio (K), rubidio (Rb), cesio (Cs) y francio (Fr), mostrados en la Fig. 2.4.2. Los metales alcalinos son los más reactivos entre los metales en la tabla periódica. Reaccionan vigorosamente con agua, como se muestra en la Fig. 2.4.3.





Figura2.4.2: Metales alcalinos, de izquierda a derecha: litio, sodio, potasio, rubidio y cesio. Fuente: Tomihahndorf en Wikipedia alemana, Dnn87 Correo electrónico de contacto: Dnn87@yahoo.dk, y http://images-of-elements.com/potassium.php.
El hidrógeno está en el grupo 1 pero no está incluido en los metales alcalinotérreos. El hidrógeno es un no metal y tiene propiedades muy diferentes a las de los metales alcalinos o cualquier otro grupo de elementos.
El segundo grupo se llama metales alcalinotérreos. Incluye berilio (Be), magnesio (Mg), calcio (Ca), estroncio (Sr), bario (Ba) y radio (Ra). Son metales reactivos pero menos reactivos que los metales alcalinos. Los metales alcalinotérreos imparten color característico a una llama. Las sales de metales alcalinos se utilizan en la formulación de fuegos artificiales para dar colores distintivos a los fuegos artificiales, como se muestra en la Fig. 2.4.4.

Los grupos 3 a 12 se denominan metales de transición. Incluyen metales preciosos como el oro, la plata, el platino y los metales de construcción como el hierro. Algunos hacen catalizadores y se encuentran en enzimas y otras biomoléculas, como la hemoglobina y la clorofila.
Grupo 13 al grupo 16 no tiene un nombre único. Comprenden no metales en la parte superior y metales en la parte inferior de cada grupo llamados metales posteriores a la transición. Los no metales importantes incluyen carbono, nitrógeno, oxígeno, fósforo y azufre.
Los elementos del grupo 17 se denominan halógenos. Los halógenos incluyen flúor (F), cloro (Cl), bromo, yodo (I) y astatina (At). Los halógenos son no metales altamente reactivos. El cloro es gas, el bromo es líquido y el yodo es sólido a temperatura ambiente, como se muestra en la Fig. 2.4.5.

El grupo 18 se llama gases nobles. Incluyen helio (He), neón (Ne), argón (Ar), criptón (Kr), xenón (Xe) y radón (Rn). Son los menos reactivos de todos los elementos. Los gases nobles se utilizan para crear una atmósfera inerte para reacciones químicas. Los gases nobles también se utilizan en el sistema de iluminación debido a su naturaleza químicamente inerte, como se ilustra en la Fig. 2.4.6.

Metales, metaloides y no metales
Metales
Los elementos hacia la esquina inferior derecha de la tabla periódica son metales a excepción del hidrógeno, que es un no metal. Los metales tienen características comunes, que incluyen:
- son brillantes,
- sólido a temperatura ambiente (excepto mercurio que es líquido),
- maleable (se puede martillar en hojas) y dúctil (se puede dibujar en alambres),
- buenos conductores de calor y electricidad, y
- tienden a perder electrones y formar compuestos iónicos cuando reaccionan con no metales.
Los metales del grupo 1 se denominan metales alcalinos; el grupo 2 se denominan metales alcalinotérreos, del grupo 3 al grupo 13 se denominan metales de transición, los metales de transición de dos filas inferiores en la tabla periódica se llaman lantanoides, y los actínidos o metales de transición internos, y los metales del grupo 13 al grupo 16 se denominan metales posteriores a la transición. Los elementos distintos de los metales de transición o de transición interna, es decir, los elementos de los grupos 1 y 2 y los grupos 13 a 18, se denominan colectivamente elementos del grupo principal o elementos representativos.
Metaloides
La línea divisoria entre metales y no metales es una línea de escalera que comienzaB5 y termina enAt85. Los elementos en la línea de escalera son metaloides a excepción del aluminio y el polonio, los cuales se consideran metales. Los metaloides tienen propiedades entre metales y no metales; por ejemplo, tienen una conductividad térmica y eléctrica moderadas.
No metales
Los elementos hacia la esquina superior derecha de la tabla periódica y el hidrógeno se denominan no metales.
- Los no metales suelen tener propiedades opuestas a los metales, por ejemplo, no son típicamente brillantes, quebradizos si son sólidos, y malos conductores de calor y electricidad.
- Los no metales tienden a producir compuestos iónicos aceptando electrones de metales y haciendo compuestos moleculares al reaccionar entre sí.
Dos grupos en los no metales también tienen nombres únicos, es decir, el grupo 17 se llama halógenos, y el grupo 18 se llama gases nobles.
Generalmente, los metales alcalinos son los más reactivos, seguidos de los metales alcalinotérreos, y los halógenos son los no metales más reactivos. Los gases nobles son los no metales menos reactivos, también llamados gases inertes.
La Fig. 2.4.7 muestra ejemplos de un metal, un metaloide y un no metal.



Elementos esenciales para la vida
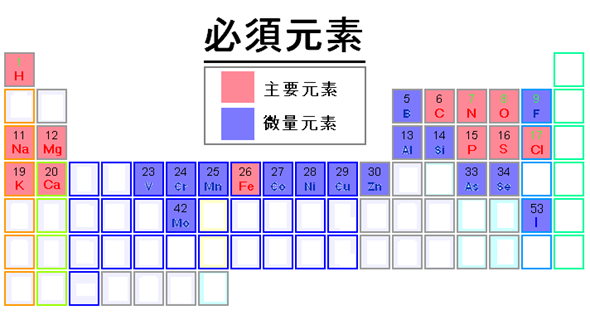
Los elementos que son los principales constituyentes de los humanos y otros organismos vivos son el oxígeno, el carbono, el hidrógeno, el nitrógeno y el azufre. El fósforo está presente en el hueso, los dientes y el ADN. El calcio y el magnesio son los principales constituyentes de los huesos y los dientes y realizan algunas otras funciones corporales. Los cationes sodio y potasio son los principales electrolitos en los fluidos corporales, y el anión cloruro equilibra la carga. El hierro está presente en la hemoglobina que transporta oxígeno a las células. Estos elementos son esenciales para la vida, y son macronutrientes. Además de estos, se necesitan varios otros elementos en una pequeña cantidad. Son esenciales para la vida y se llaman micronutrientes. La Fig. 2.4.8 muestra los macronutrientes en rosa y los micronutrientes en color azul en una tabla periódica.
Estados físicos y químicos de los elementos
Elementos en estado de gases en condiciones ambientales
El término molécula se usa generalmente para un grupo eléctricamente neutro de dos o más átomos mantenidos juntos por enlaces químicos. En la teoría molecular cinética de los gases, una molécula es la partícula más pequeña de un elemento o compuesto con una existencia estable e independiente. Los átomos de los gases nobles existen como especies independientes en la fase gaseosa a temperatura ambiente, es decir, como moléculas monoatómicas como He, Ne, Ar, Kr, Xe y Rn. Otros elementos que son gases a temperatura ambiente o moléculas diatómicas, es decir, H 2, N 2, O 2, F 2 y Cl 2, se denominan dihidrógeno, dinitrógeno, dioxígeno y diclorina, respectivamente. Tenga en cuenta que generalmente el prefijo di no se usa para el nombre del elemento, es decir, estos generalmente se denominan hidrógeno, nitrógeno, oxígeno, flúor y cloro, respectivamente. Existen especies monoatómicas de estos elementos, es decir, H, N, O, F y Cl, pero son especies muy reactivas llamadas radicales libres, y no sobreviven por mucho tiempo.
Elementos en estado líquido en condiciones ambientales
Dos elementos existen como líquidos a temperatura ambiente, es decir, mercurio (Hg), un metal, y bromo (Br 2), un no metal que existe como moléculas diatómicas. Cuatro elementos, francio, cesio, galio y rubidio, son metales sólidos a 25 o C, pero se vuelven líquidos cuando la temperatura es ligeramente más cálida.
Elementos en estado sólido en condiciones ambientales
Todos los elementos no mencionados en las dos secciones anteriores son sólidos a temperatura ambiente. Pueden ser moléculas diatómicas o poliatómicas, por ejemplo, I 2, O 3, P 4, S 8, diyodo, ozono, tetraposforo y octasulfur, con dos o tres, cuatro y ocho átomos, respectivamente, en una molécula.
Alótropos
Diferentes formas del mismo elemento en el mismo estado físico se llaman alótropos.
Los alótropos son diferentes modificaciones estructurales del elemento. Por ejemplo, el carbono existe en varias formas alotrópicas; dos de ellas se muestran en la Fig. 2.4.9. Otro ejemplo es O 2, y O 3 son formas gaseosas de oxígeno.

Elementos que existen como moléculas gigantes
Algunos elementos existen como moléculas gigantes, es decir, una colección de muchos átomos unidos entre sí a través de una red 3D de enlaces. Por ejemplo, el carbono es una molécula gigante en varias formas alotrópicas, incluyendo diamante, grafito, nanotubos de carbono y fullerenos. La Fig. 2.4.9 muestra la unión en alótropos de diamante y grafito. Toda la pieza de diamante es una molécula con átomos de carbono interconectados en una red 3D de enlaces.
Los metales también existen como una colección de muchos átomos unidos entre sí por enlaces metálicos. Los átomos metálicos existen como iones +dispuestos en una disposición 3D bien definida llamada red cristalina con algunos de los electrones más externos vagando alrededor de toda la pieza del metal, formando un mar de electrones alrededor de los átomos metálicos, como se ilustra en la Fig. 2.4.10.
Los elementos en moléculas gigantes y metales están representados por símbolos de elementos sin ningún subíndice, por ejemplo, C es carbono, Fe es hierro, Au es oro, etc.



