2.5: Electrones en átomos
( \newcommand{\kernel}{\mathrm{null}\,}\)
La estructura electrónica de un átomo determina las propiedades del elemento. El conocimiento de la radiación electromagnética se describe primero ya que juega un papel esencial en la comprensión de la estructura electrónica de los átomos.

Radiaciones electromagnéticas
Las radiaciones electromagnéticas son ondas que son campos eléctricos y magnéticos oscilantes. La onda se propaga en una dirección, por ejemplo, a lo largo del eje x. El campo eléctrico oscila perpendicular a él, por ejemplo, a lo largo del eje y. El campo magnético oscila perpendicular a ambos, por ejemplo, a lo largo del eje z, como se ilustra en la Fig. 2.5.1. La distancia entre dos máximos consecutivos o entre dos puntos de fase iguales consecutivos a lo largo de la onda se denomina longitud de onda (λ, pronunciada 'lambda'). El número de ondas que pasan un punto de referencia en un segundo se denomina frecuencia (ν, pronunciado 'nu'). La velocidad de la radiación electromagnética se llama la velocidad de la luz (c). La velocidad de la luz es la longitud de onda y frecuencia del producto, es decir,
c=λν
La velocidad de la luz (c) es 3.00 x 10 8 m/s en vacío. La energía (E) de la radiación electromagnética es directamente proporcional a la frecuencia, es decir,
E=hν
, donde h es una constante, llamada constante de tablón. Reemplazarν concλ muestra que la energía es inversamente proporcional a la longitud de onda.
E=hcλ
La figura 2.5.2 ilustra el rango de radiaciones electromagnéticas que difieren entre sí en cuanto a longitud de onda, frecuencia o energía. La separación de las radiaciones en función de su longitud de onda da un espectro. La luz visible es una pequeña porción del espectro de radiaciones electromagnéticas, como se ilustra en la Fig. 2.5.2.

Espectro continuo y lineal
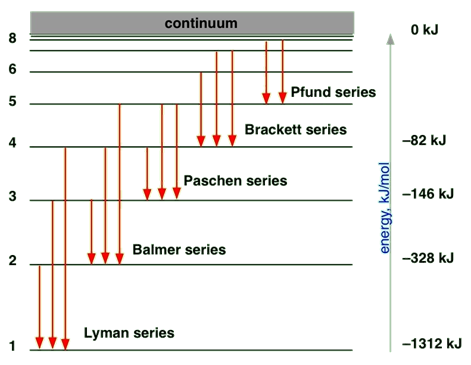
El espectro de luz solar contiene radiaciones de todas las longitudes de onda dentro del rango visible. El espectro que contiene todas las longitudes de onda en el rango se llama espectro continuo. El espectro de las lámparas de sodio o las emisiones de otros átomos contiene solo algunas longitudes de onda discretas. El espectro que contiene longitudes de onda discretas se llama espectro de línea. Por ejemplo, como se ilustra en la Fig. 2.5.3, la emisión del átomo de hidrógeno es un espectro lineal.


Niveles de energía de electrones en un átomo
La pregunta es por qué la emisión atómica tiene una longitud de onda discreta o energía discreta. La respuesta a esta pregunta provino de los descubrimientos que concluyeron que el electrón en un átomo no tiene valores continuos de energía; tienen valores discretos de energía llamados conchas y subconchas.
El caparazón
Los números cuánticos determinan los valores de energía permitidos de un electrón en un átomo.
- El número cuántico principal (n) puede tener cualquier valor entero a partir de 1, es decir, 1, 2, 3, 4, y así sucesivamente.
- Cuanto más pequeño es el n, menor es el estado energético, y cuanto más cerca está el electrón del núcleo, más apretado está el electrón por el núcleo.
- El valor de n define el shell, es decir, 1 st shell tiene n = 1, 2 nd shell tiene n = 2, 3 rd shell tiene n =3, y así sucesivamente.
Bohr introdujo este concepto de cuantificación de los niveles de energía electrónica. La Fig. 2.5.4 ilustra el modelo atómico de Bohr.
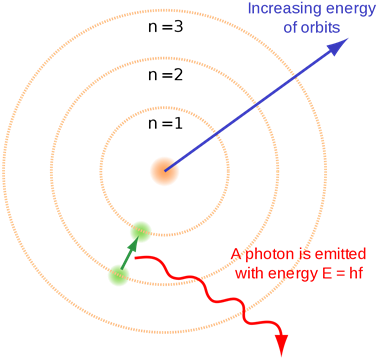
- Cuando un electrón salta de una capa inferior a una capa superior, absorbe radiación electromagnética de energía igual a la brecha de energía entre la capa inicial y la capa final.
- Cuando un electrón salta de una capa superior a una capa inferior, emite radiación igual a la brecha de energía entre la capa inicial y la capa final.
La Fig. 2.5.3 ilustra la emisión de radiación de los átomos, es un espectro lineal porque solo se permiten niveles discretos de energía, llamados conchas, a los electrones en un átomo.

El subshell
Un segundo número cuántico, llamado número cuántico azimutal (l) define subconchas dentro de un caparazón.
Las subconchas suelen designarse como s, p, d, f,...
Cada shell tiene subshells iguales al número de shell. Por ejemplo, 1 st tendrá sólo una subshell, es decir, s. se designa 1s, donde el número es el número cuántico principal, y la letra es la subshell. El segundo caparazón tiene dos subconchas 2s y 2p; el caparazón 3 rd tiene tres subconchas 3s, 3p y 3d; y el 4º shell tiene cuatro subconchas 4s, 4p, 4d y 4f.
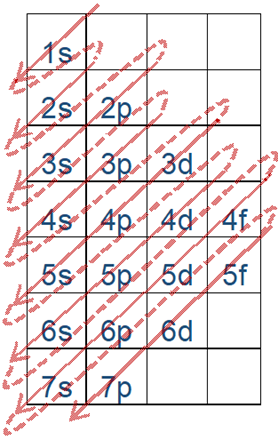
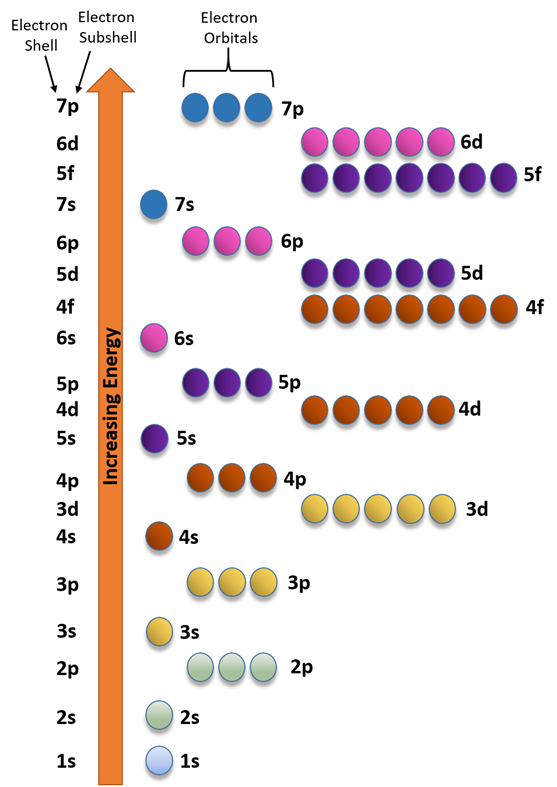
El orden energético de las subconchas es 1s<2s<2p<3s<3p<4s y así sucesivamente.
La Fig. 2.5.6 ayuda a recordar el orden. Esta figura se dibuja colocando los orbitales en columnas y los números de shell en filas en orden creciente de n de arriba a abajo, comenzando desde 1s orbitales en la primera columna y primera fila, p orbitales en la segunda, d en la tercera y f en la cuarta. El relleno de electrones sigue flechas que van de esquina a esquina, comenzando por la esquina superior izquierda de la celda superior, como se describe con más detalle en una sección posterior.
El orbital es la región en el espacio alrededor del núcleo de un átomo donde más probablemente se encuentran electrones.
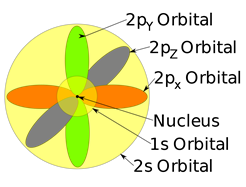
Cada subshell tiene un cierto número de orbitales en ellos. Los orbitales tienen una forma y orientación específicas. La subcapa s tiene solo una órbita esféricamente simétrica, como una bola con un núcleo en el centro. El orbital 1s es menor que 2s, y 2s es menor que 3s, pero todos tienen una forma esféricamente simétrica, como se ilustra en la Fig. 2.5.5. El subshell p tiene tres orbitales. Cada orbital p es una forma de mancuerna con dos lóbulos, es decir, p x orientados a lo largo del eje x, p y a lo largo del eje y, y pz a lo largo del eje z, como se ilustra en la Fig. 2.5.5.
Un conjunto de orbitales que tienen la misma energía se llama orbitales degenerados.
Todos los tres orbitales p en el mismo caparazón tienen la misma energía, i, e, 2p x, 2p y, y 2p z es un conjunto de orbitales degenerados. La subcapa d tiene cinco orbitales degenerados, y la subcapa f tiene siete orbitales degenerados, como se muestra en la Fig. 2.5.7. Sus formas y orientaciones son más complejas y no se muestran aquí.
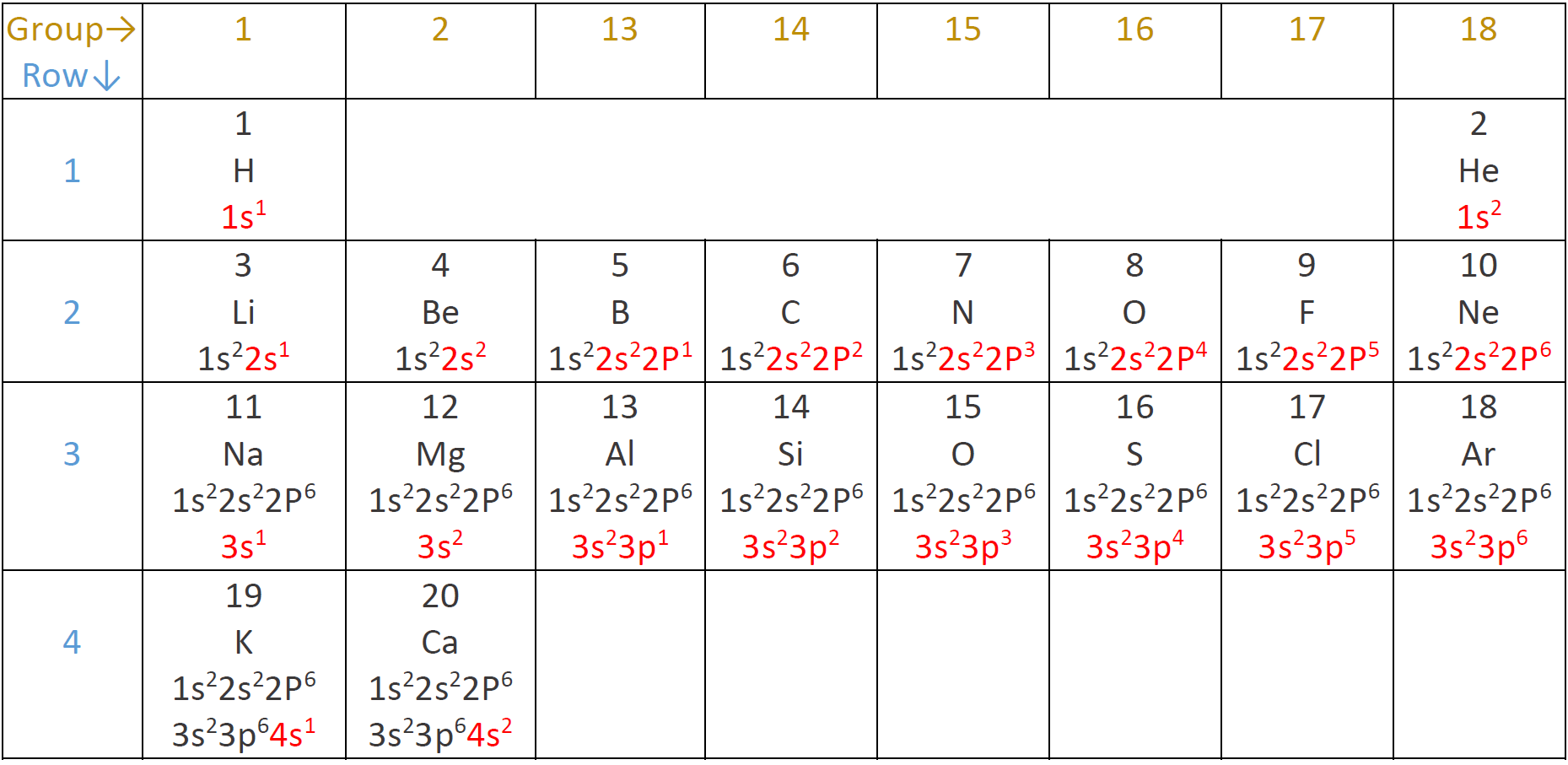
La configuración electrónica de los átomos
La configuración electrónica es la distribución de electrones en los orbitales del átomo.
- Cada orbital puede tomar un máximo de dos electrones.
- Los orbitales se llenan en el orden de energía creciente: el orbital de energía más baja se llena de electrones antes de que el siguiente orbital de mayor energía comience a llenarse.
El orden energético de los orbitales es 1s<2s<2p<3s<3p<4s y así sucesivamente, como se muestra en la Fig. 2.5.6 y Fig. 2.5.7.
La configuración electrónica de los elementos de la primera fila
El átomo de hidrógeno tiene un electrón, y ocupa 1s orbital, es decir, 1s 1 representa la configuración electrónica del átomo de hidrógeno. El superíndice en 1s 1 muestra el número de electrones en la subcapa. Un átomo de helio tiene dos electrones, y ambos ocupan 1s orbitales, dando helio la configuración electrónica de 1s 2. El hidrógeno y el helio están en la primera fila de la tabla periódica y tienen la primera capa que contiene electrones.
La configuración electrónica de los elementos de la segunda fila
La 2da fila parte del litio con 3 electrones: los dos primeros ocupan 1s, y la tercera ocupan 2s dando litio la configuración electrónica 1s 2 2s 1. El siguiente elemento es el berilio con 4 electrones con la configuración 1s 2 2s 2. El siguiente elemento es un boro con 5 electrones y la configuración electrónica 1s 2 2s 2 2p 1. El carbono tiene 6 electrones con la configuración electrónica 1s 2 2s 2 2p 2. Recuerde que la subcapa s tiene un orbital y puede tomar un máximo de dos electrones, pero la subcapa p tiene tres orbitales y puede tomar un máximo de seis electrones, es decir, dos por orbital. Nitrógeno, oxígeno, flúor y neón tienen 7, 8, 9 y 10 electrones y tienen la configuración electrónica 1s 2 2s 2 2p 3, 1s 2 2s 2 2p 4, 1s 2 2s 2 2p 5, y 1s 2 2s 2 2p 6, respectivamente. El número atómico 3 al 10, es decir, litio a neón, completa la segunda fila.
La capa más externa se llama la capa de valencia, y los electrones en la capa de valencia se llaman electrones de valencia. La primera capa es la capa de valencia para los elementos de la 1ª fila hidrógeno y helio. Los elementos de la segunda fila tienen una capa interna con configuración 1s 2, y una capa de valencia que contiene 2s y 2p siendo llenado. La capa interna también se llama núcleo-cubierta, y los electrones en el núcleo-cubierta se llaman electrones centrales.
La configuración electrónica de los elementos de tercera fila y cuarta fila
La tercera fila comienza con el número atómico de sodio 11 y termina con el número atómico de argón 18. La configuración electrónica de los elementos de la tercera fila repite el patrón de la segunda fila, es decir, un conjunto de cáscaras de núcleo completas 1s 2 2s 2 2p 6, y una capa de valencia que tiene 3s o 3p que se está llenando. Los dos primeros elementos de la 4ª fila son potasio y calcio con números atómicos 19 y 20 teniendo configuraciones 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 y 1s 2 2s 2 2p 6 3s 2 3p 6 3s 2 3p 6 4 s 2, respectivamente. La configuración electrónica de elementos con números atómicos más allá de 20 es más complicada, involucrando subshell d y f, y están fuera del alcance de este libro. La Fig. 2.5.8 muestra la configuración electrónica de los primeros veinte elementos descritos anteriormente.