4.4: Patrones de reacciones químicas
- Page ID
- 77184
Tipos generales de reacciones químicas
Existen varias formas de clasificar las reacciones químicas. Los tipos generales de reacciones químicas caen en las categorías de reacciones de combinación, descomposición, reemplazo y combustión, como se ilustra en la Fig. 4.4.1.
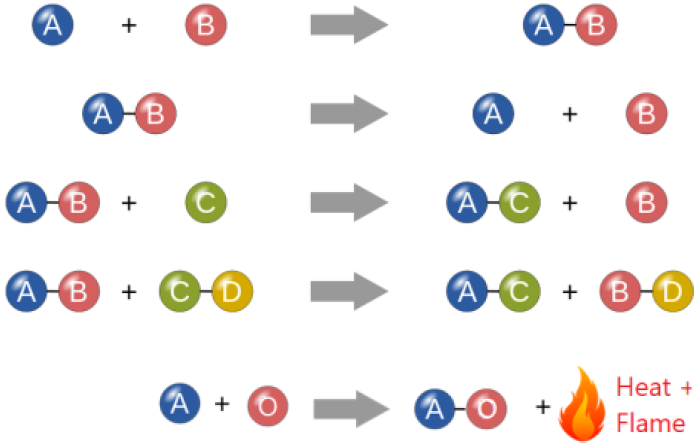
Reacciones de combinación
Un compuesto se sintetiza o se forma a partir de dos o más sustancias, por ejemplo:
\[\ce{C + O2 -> CO2}\nonumber\]
\[\ce{2H2 + O2 -> 2H2O}\nonumber\]
\[\ce{2Mg + O2 -> 2MgO}\nonumber\]
\[\ce{2Na + Cl2 -> 2NaCl}\nonumber\]
\[\ce{CaO + CO2 -> CaCO3}\nonumber\]
La Fig. 4.4.2 muestra un ejemplo de una reacción de combinación de hidrógeno con oxígeno que se está desarrollando para su uso como combustible en el futuro.

Reacciones de descomposición
Las reacciones de descomposición son las inversas de la reacción de combinación, es decir, un compuesto se divide en dos o más sustancias, usualmente por calentamiento, por ejemplo:
\[\ce{H2CO3 -> H2O + CO2}\nonumber\]
\[\ce{CaCO3 ->[\Delta] CaO + CO2}\nonumber\]
\[\ce{2KClO3 ->[\Delta] 2KCl + 3O2}\nonumber\]
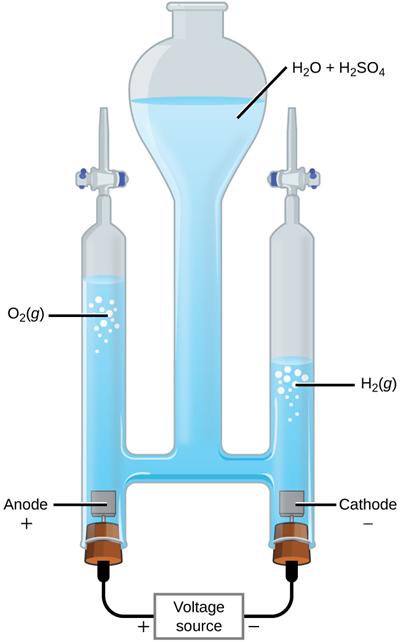
\[\ce{2H2O (l) ->[Electrolyisis] 2H2(g) + O2(g)}\nonumber\]
La Fig. 4.4.3 ilustra la última reacción, es decir, la descomposición del agua por electrólisis.
Reacciones de reemplazo o sustitución
Existen dos subclases de esta categoría de reacciones, es decir, la reacción de reemplazo simple y la reacción de reemplazo doble.
Las reacciones de reemplazo único implican que una sustancia reemplace una parte de otra, por ejemplo:
\[\ce{Zn(s) + CuCl2(aq) -> ZnCl2(aq) + Cu(s)}\nonumber\]
\[\ce{2Al(s) + 6HCl(aq) -> AlCl3(aq) + 3H2(g)}\nonumber\]
La Fig. 4.4.4 muestra un ejemplo de una única reacción de reemplazo de magnesio que da como resultado la formación de gas hidrógeno.
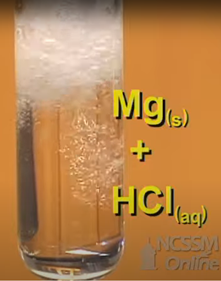
Las reacciones de doble reemplazo o metátesis implican el intercambio mutuo de parejas entre dos sustancias, por ejemplo, las siguientes reacciones de precipitación:
\[\ce{NaCl(aq) + AgNO3(aq) -> AgCl(s)(v) + NaNO3(aq)}\nonumber\]
\[\ce{Na2CO3(aq) + CaCl2(aq) -> CaCO3(s)(v) + 2NaCl(aq)}\nonumber\]
Reacciones de combustión
La combustión es una reacción de una sustancia con el oxígeno, a menudo con la formación de llama y liberación de mucho calor, por ejemplo:
\[\ce{C8H16 + 12O2 -> 8CO2 + 8H2O + Heat}\nonumber\]
\[\ce{C + O2 -> CO2 + Heat}\nonumber\]
\[\ce{2H2 + O2 -> 2H2O + Heat}\nonumber\]
\[\ce{2Mg + O2 -> 2MgO + Heat}\nonumber\]
La Fig. 4.4.5 muestra la reacción anterior, es decir, la combustión de Mg en aire.

Por lo general, la combustión se considera como la reacción de una sustancia que contiene carbono e hidrógeno con oxígeno dando como resultado dióxido de carbono, agua, llama y calor, por ejemplo, quemar metano en una estufa de cocina:
\[\ce{CH4 + 3O2 -> CO2 + 2H2O + Heat}\nonumber\]
Clasificación de la reacción química
Las reacciones químicas generalmente se clasifican en función de lo que se intercambia durante la reacción. Estos incluyen;
- la transferencia de electrones en reacciones de oxidación-reducción,
- transferencia de protones en reacciones ácido-base, y
- una parte de los reactivos se intercambia mutuamente en reacciones de precipitación, como se describe a continuación.
Reacciones de oxidación-reducción
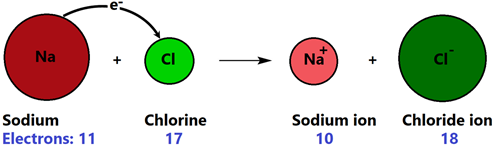
La reacción de oxidación-reducción o redox implica el intercambio de electrones. Por ejemplo, las reacciones entre un metal y un no metal implican la transferencia de electrones del metal al no metal formando un enlace iónico, como se muestra en la Fig. 4.4.6.
Reacciones ácido-base
Las reacciones ácido-base implican la transferencia de protones de un ácido a una base, como se muestra en la Fig. 4.4.7.

Walkerma, Dominio público
Reacciones de precipitación
Se trata de reacciones de doble desplazamiento en agua que dan como resultado la precipitación de uno de los productos, como se muestra en la Fig. 4.4.8.

Las reacciones de precipitación y las reacciones ácido-base se describen en los capítulos posteriores. Las reacciones de oxidación-reducción se discuten en la siguiente sección.


