4.5: Reacciones de oxidación-reducción
( \newcommand{\kernel}{\mathrm{null}\,}\)
¿Qué son la oxidación y la reducción?
La oxidación-reducción se define de tres maneras:
- O xidación i s l oss de electrones y r educción i s la g ain de electrones. La palabra OIL RIG ayuda a recordar esta definición.
- La adición de oxígeno es oxidación, y la eliminación de oxígeno es una reducción.
- La eliminación de hidrógeno es oxidación, y la adición de hidrógeno es una reducción.
La reacción oxidación-reducción o en breve redox es uno de los tipos más comunes de reacciones químicas que ocurren dentro y alrededor de nosotros. Por ejemplo, la oxidación de los metales, la fotosíntesis, la digestión de los alimentos y la combustión de combustibles son reacciones redox.

Reacciones de oxidación-mitad y reducción-mitad
Las reacciones de oxidación-reducción ocurren en un par porque una cosa pierde electrones y se oxida; la otra cosa gana los electrones y se reduce. Es por ello que comúnmente se le llama reacción redox, donde el rojo- representa la reducción y —el buey representa la oxidación.
La pátina verde sobre la estatua de la libertad, mostrada en la Fig. 4.5.1, es resultado de la oxidación del cobre:
2Cu(s)+O2(g)⟶CuO(s)
La transferencia de electrones se hace evidente cuando la reacción se divide en la mitad de oxidación y la mitad de reducción. La mitad de oxidación es:
Cu⟶Cu2++2e−
el cobre perdió electrones, por lo que el cobre es óxidos. La mitad de reducción es:
O2+4e−⟶2O2−
El oxígeno ganó electrones, por lo que el oxígeno se reduce.
- La sustancia que oxida otra sustancia es un agente oxidante. El oxígeno es un agente oxidante en la reacción anterior, ya que oxida el cobre.
- La sustancia que reduce otra sustancia es un agente reductor. El cobre es un agente reductor en la reacción anterior, ya que reduce el oxígeno.
Los electrones perdidos en una mitad de oxidación deben ser iguales a los electrones ganados por la mitad de reducción acompañante. Multiplicar la mitad de oxidación con 2 hace que los electrones perdidos sean iguales a los electrones ganados en la mitad de reducción en la reacción anterior. A continuación, la adición de la oxidación y la mitad de reducción da la reacción global:
2Cu⟶2Cu2++4e−
O2+4e−⟶2O2−
Overall reaction: 2Cu(s)+O2(g)⟶CuO(s)
Las ecuaciones químicas pueden ser manipuladas como ecuaciones algebraicas, es decir, pueden ser multiplicadas o divididas por una constante, sumadas y restadas, como se demuestra en el ejemplo de las reacciones de media redox de cobre anteriores. Tenga en cuenta que los electrones en un lado de la ecuación cancelaron los electrones del otro lado de la ecuación durante la operación de adición.
Una tira de zinc de color plata sumergida en solución de nitrato de cobre se recubre con una capa de cobre de color rojizo, como se muestra en la Fig. 4.5.2. La ecuación molecular de la reacción, que muestra unidades de fórmula de compuestos en los reactivos y productos, es:
Zn(s)+Cu(NO3)2(aq)⟶Cu(s)+Zn(NO3)2(aq)
La ecuación iónica completa para la reacción se obtiene mostrando los compuestos iónicos disueltos como iones, por ejemplo:
Zn(s)+Cu2+(aq)+2NO−3(aq)⟶Cu(s)+Zn2+(aq)+2NO−3(aq)
La mitad de oxidación de la reacción es:
Zn(s)⟶Zn2+(aq)+2e−
La reducción-mitad de la reacción es:
Cu2+(aq)+2e−⟶Cu(s)
La ecuación iónica neta que es la adición de la mitad de oxidación y la mitad de reducción es:
Zn(s)+Cu2+(aq)⟶Cu(s)+Zn2+(aq)
Tenga en cuenta que NO 3 - estaba en ambos lados de la ecuación iónica completa y se ha cancelado en la ecuación iónica neta:
Zn(s)+Cu2+(aq)+2NO−3(aq)⟶Cu(s)+Zn2+(aq)+2NO−3(aq)
Los iones que no participan en la reacción química se denominan iones espectadores, y aparecen en ambos lados de la ecuación molecular, como el NO 3 -en este caso-.
Reacciones biológicas de oxidación y reducción
En las reacciones redox que involucran especies metálicas, la transferencia de electrones suele ser evidente a través de las reacciones de la mitad de oxidación y la mitad de reducción, como en los ejemplos anteriores. En las reacciones redox orgánicas y bioquímicas, la transferencia de electrones no suele ser tan obvia, pero la transferencia de hidrógeno u oxígeno suele ser aparente. Por ejemplo, el metabolismo del metanolH3C−OH comienza con la oxidación a través de la pérdida de hidrógeno:
H3C−OH⟶H2C=O+2H
El metanol se oxida a formaldehídoH2C=O. El formaldehído se oxida aún más al ganar oxígeno:
H2C=O⟶HCOOH
Finalmente, el ácido fórmico (HCOOH) se oxida al obtener oxígeno y formar dióxido de carbono y agua:
2HCOOH⟶2O=C=O+2H2O
El incremento en el enlace C-O de un enlace sencillo en metanol a dos dobles enlaces (cuatro enlaces C-O) en dióxido de carbono es una clara indicación de la oxidación del carbono.
La eliminación de hidrógeno también es oxidación, por ejemplo, el hidroximalonato se oxida a oxomalonato por una enzima hidroximalonato deshidrogenasa:
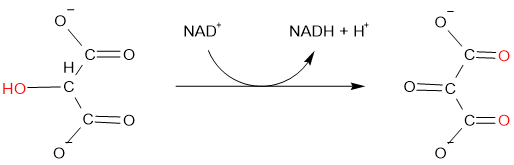
Lo inverso de estos, es decir, la eliminación de oxígeno y la adición de hidrógeno es la reducción.


