4.3: Reacción química
( \newcommand{\kernel}{\mathrm{null}\,}\)
¿Qué es una reacción química?
Una reacción química es una combinación, separación o reordenamiento de átomos en una sustancia.
Los átomos se curan juntos en una sustancia por enlaces químicos. La combinación hace enlaces, la separación rompe enlaces y el reordenamiento rompe algunos de los enlaces antiguos y hace algunos enlaces nuevos en las sustancias durante una reacción química. Da como resultado nuevas sustancias con una composición de elementos diferente a la de las sustancias de partida. Las sustancias de partida se llaman reactivos y las nuevas sustancias formadas se llaman productos.
Cuando se rompe un enlace químico se requiere energía y cuando se forma un enlace químico se libera energía. La cantidad de energía dependía del enlace químico, pero para el mismo enlace, la energía que necesita romperse es la misma energía liberada para hacer el enlace. Por lo tanto, la energía se libera en algunas reacciones químicas y se absorbe en otras.
Ejemplos de reacciones químicas son la fotosíntesis que convierte el dióxido de carbono y el agua en glucosa en las hojas verdes de las plantas usando energía de la luz solar. La digestión de los alimentos es una reacción química que libera la energía necesaria para el funcionamiento de los seres vivos. La quema de una vela es una reacción química que convierte los compuestos orgánicos en el fule en dióxido de carbono, agua y energía térmica. El hierro oxidado es otra reacción química que convierte el elemento hierro en óxido de hierro compuesto.
Indicaciones de una reacción química
Una reacción química suele ir acompañada de algunos cambios físicos que se pueden observar. Los cambios incluyen cambio de color, llama, calor, luz, la evolución de un gas, formación de un precipitado, etc., como se ilustra en la Fig. 4.3.1




Representando una reacción química- una ecuación química
Una ecuación química representa una reacción química.
- Las fórmulas de los reactivos están escritas en el lado izquierdo separadas por un signo +.
- Las fórmulas de los productos están escritas en el lado derecho separadas por un signo +.
- Una flecha que apunta en la dirección de los productos separa los reactivos de los productos.
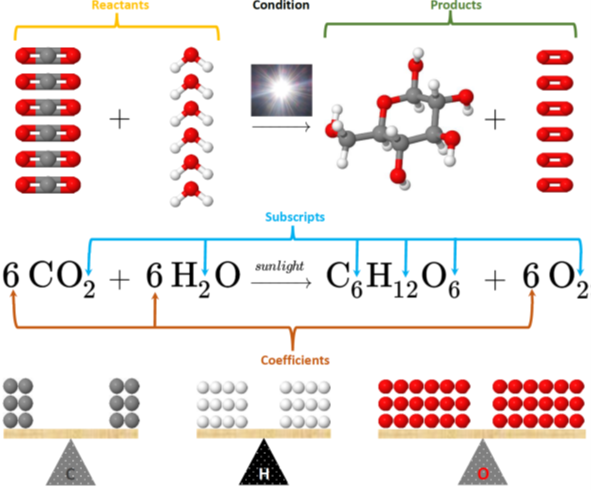
La Fig. 4.3.2 ilustra la reacción de fotosíntesis entre dióxido de carbono (CO2y agua (H2Oproduciendo glucosa (C6H12O6y oxígeno (O2:
6CO2+6H2Osunlight→C6H12O6+6O2
- Primero se escriben fórmulas correctas de reactivos y productos, separados por signos más y flechas.
- Entonces el número de especies se ajusta sumando un número, llamado coeficiente, al inicio de una fórmula. Los coeficientes son necesarios para hacer que los átomos de cada elemento sean iguales en ambos lados de la ecuación porque los átomos no son creados ni destruidos en una reacción química.
- Los subíndices dentro de las fórmulas no se pueden cambiar ya que representan la composición de la sustancia que es constante.
- El coeficiente no se escribe si es uno.
Por ejemplo, la Fig. 4.3.2 muestra coeficientes 6 para dióxido de carbono, agua y oxígeno, pero ningún coeficiente para glucosa significa que el coeficiente es realmente uno para la glucosa en una ecuación química equilibrada para la reacción de fotosíntesis.
En ocasiones el estado físico de las sustancias se muestra mediante símbolos entre corchetes pequeños junto a la fórmula.
- Los símbolos para el estado físico son: (s) para sólido, (l) para líquido, (g) para gas y (aq) para una sustancia disuelta en agua. El símbolo (aq) significa acuoso, es decir, agua.
- Si un gas evoluciona, se puede mostrar con una flecha hacia arriba (↑), y si se forma un precipitado, se muestra con una flecha hacia abajo (↓).
Por ejemplo, la combustión de butano (ceC4H10en el encendedor mostrado en la Fig. 4.3.1. puede representarse como:
2C4H10(g)+13O2(g)⟶8CO2(g)+10H26O(g)
, donde todos los reactivos y productos se encuentran en fase gaseosa. La reacción de NaCl y AgnO 3 en el agua que da como resultado un precipitado, como se muestra en la Fig. 4.3.1 es:
NaCl(aq)+AgNO3(aq)⟶AgCl(s)↓+NaNO3(aq)
, donde NaCl, AgnO 3 y NaNO 3 están en el agua, y AgCl precipita como un sólido blanco. La reacción de la piedra caliza con HCl, mostrada en la Fig. 4.3.1 es:
CaCO3(s)+2HCl(aq)⟶CaCl2(aq)+H2O(l)+CO2(g)↑
Las condiciones de reacción, los catalizadores o el calor se pueden escribir arriba o debajo de la flecha. El calor también puede ser representado por el símbolo ΔO, por ejemplo,
CaCO3(s)+CaO(s)Δ→CO2(g)↑
Una flecha de dos vías−⇀↽− o⇆ representa una reacción de dos vías, p.
2NO2(g)−⇀↽−N2O4(g)
Equilibrar una ecuación química
El primer paso es escribir fórmulas correctas de reactivos y productos separados por signos más y una flecha. Por ejemplo, la ecuación inicial para quemar quemaduras de hidrógeno en oxígeno y producir agua sería:
H2+O2⟶H2O
Tenga en cuenta que el hidrógeno se escribe como H 2 (no H) y el oxígeno como O 2 (no O) porque estos reactivos suelen existir como moléculas, no como átomos.
El siguiente paso es sumar coeficientes para equilibrar los átomos de cada elemento en los dos lados de la ecuación. Por ejemplo, en la ecuación anterior el hidrógeno está equilibrado pero el oxígeno no lo es. Equilibrar el oxígeno cambiando el coeficiente de agua de 1 a 2:
H2+O2⟶2H2O
Los subíndices en las fórmulas no se pueden cambiar, ya que son constantes. Por ejemplo, si O 2 se cambia a O en la ecuación anterior para equilibrar el oxígeno, es incorrecto ya que O 2 es oxígeno molecular que es un químico diferente al oxígeno atómico O.
El coeficiente es un multiplicador de cada subíndice en la fórmula, es decir, en 2H 2 O hay 2x2 = 4 hidrógeno y 2x1 =2 oxígeno. Ahora busque de nuevo los otros elementos: tenga en cuenta que los átomos de hidrógeno han cambiado a 4 en el lado derecho. Para equilibrar hidrógeno, cambie el coeficiente de H 2 de 1 a 2:
2H2+O2⟶2H2O
Revisar de nuevo: Ahora, los átomos de cada elemento son los mismos en ambos lados, es decir, la ecuación está equilibrada, como se ilustra en la Fig. 4.3.3.

Reglas para equilibrar una ecuación química
El método descrito anteriormente para equilibrar una ecuación química se denomina método de golpe y prueba. No hay reglas duras y rápidas en este método. Los lineamientos generales son:
- si un elemento se presenta solo en un reactivo y un producto, equilibrarlo primero,
- si hay un elemento libre en los reactivos o productos, equilibrado último,
- si hay un ion poliatómico en reactivos y productos, equilibrar el número de iones poliatómicos como una unidad, es decir, agregar coeficiente a pero no cambiar los subíndices en el ion poliatómico o de cualquier fórmula.
- en algunos casos, se necesita un coeficiente fraccionario para equilibrar la ecuación, en ese caso primero usar el coeficiente fraccional y cuando la ecuación está equilibrada, eliminar la fracción multiplicando todos los coeficientes con un multiplicador común,
- si el conjunto de coeficientes en la ecuación balanceada no está en la relación de número entero más simple, la ecuación sigue siendo equilibrada, pero se recomienda convertir el conjunto de coeficientes a la relación de número entero más simple.
Los siguientes ejemplos explican las pautas.

La combustión de propano (C 3 H 8) se utiliza en la soldadura de gas, como se muestra en la Fig. 4.3.4. El propano reacciona con el oxígeno y produce dióxido de carbono y agua. Escribir y equilibrar la ecuación química de la reacción?
Solución
Comience con escribir las fórmulas correctas de reactivos y productos en forma de ecuación química:
C3H8+O2⟶CO2+H2O
De acuerdo con la regla 1, mira primero al carbono o al hidrógeno. Ambos no están equilibrados. Equilibrar el carbono cambiando el coeficiente de CO 2 de 1 a 3:
C3H8+O2⟶3CO2+H2O
Equilibrar el hidrógeno cambiando el coeficiente de H 2 O de 1 a 4:
C3H8+O2⟶3CO2+4H2O
Ahora, mira el oxígeno (regla 2) y equilibrarlo cambiando el coeficiente de O 2 de 1 a 5:
C3H8+5O2⟶3CO2+4H2O
La última ecuación está equilibrada, como se ilustra en la Fig. 4.3.5.

La reacción entre el polvo metálico de aluminio y el óxido de hierro, llamada reacción de termita, es altamente exotérmica que funde el ion. La reacción de termita se utiliza para la soldadura de ferrocarriles como se muestra en la Fig. 4.3.6. Wright y equilibrar la ecuación de reacción.
Solución
Comience con escribir las fórmulas correctas de reactivos y productos en forma de ecuación química:
Al+Fe2O3⟶Fe+Al2O3
La regla 1 no se aplica ya que todos los elementos están en un reactivo y un producto. De acuerdo con la regla 2, mira cualquiera de los compuestos. Equilibrar aluminio cambiando el coeficiente en el eactante de 1 a 2:
2Al+Fe2O3⟶Fe+Al2O3
Ahora balancea el hierro cambiando su coeficiente de 1 a 2 en el producto:
2Al+Fe2O3⟶2Fe+Al2O3
Todos los átomos están equilibrados en esta etapa y los coeficientes están en la relación de número entero más simple. Entonces la ecuación está equilibrada.

El metanol (CH 4 O) reacciona con el oxígeno y produce dióxido de carbono y agua. ¿Escribir y equilibrar la ecuación de reacción química?
Solución
La ecuación inicial con fórmulas correctas es:
CH4O+O2⟶CO2+H2O
De acuerdo con la regla 1, mira primero al carbono y al hidrógeno. El carbono ya está equilibrado. Hay 4 hidrógenos a la izquierda pero solo dos en el lado derecho, así que equilibrarlos cambiando el coeficiente de agua de 1 a 2:
CH4O+O2⟶CO2+2H2O
Ahora, mira el oxígeno (regla 2). Hay tres átomos de oxígeno a la derecha (uno en metanol y dos en oxígeno de elemento libre) pero cuatro oxígeno a la derecha, no está equilibrado. Al cambiar el coeficiente de CH 4 O de 1 a 2 se equilibra el oxígeno, pero el carbono y el hidrógeno se desequilibran. Cambiar el coeficiente de O 2 de 1 a 2 no equilibra el oxígeno. Un coeficiente fraccionario 3/2 para O 2 funciona en esta etapa (regla 4):
CH4O+32O2⟶CO2+2H2O
Todos los elementos están equilibrados, es decir, la ecuación está balanceada, pero, según la regla 5, es mejor eliminar la fracción multiplicando cada coeficiente de la ecuación por 2:
2CH4O+3O2⟶2CO2+4H2O
El conjunto de coeficientes en la ecuación balanceada ya está en la relación de número entero más simple, por lo que no se necesita más paso en este caso.
El aluminio reacciona con ácido sulfúrico para producir sulfato de aluminio e hidrógeno gaseoso. Wright una ecuación química equilibrada para la reacción.
Solución
La ecuación de partida con fórmulas correctas de reactivos y productos es:
Al+H2SO4⟶Al2(SO4)3+H2
Todos los elementos ocurren en un reactivo y un producto, por lo que no se aplica la regla 1. De acuerdo con la regla 2, dejar el aluminio hasta el final y, de acuerdo con la regla 3, equilibrar el ion poliatómico (SO 4 2 -) como una unidad cambiando el coeficiente de ácido sulfúrico de 1 a 3:
Al+3H2SO4⟶Al2(SO4)3+H2
Ahora equilibra el hidrógeno cambiando su coeficiente de 1 a 3:
Al+3H2SO4⟶Al2(SO4)3+3H2
Finalmente balancear el aluminio cambiando su coeficiente de 1 a 2:
2Al+3H2SO4⟶Al2(SO4)3+3H2
Doble comprobación al final —Todos los elementos están equilibrados y todos los coeficientes están en la relación de número entero más simple. No se necesita ningún paso más.


