6.4: Equilibrio ácido-base
( \newcommand{\kernel}{\mathrm{null}\,}\)
La mayoría de las reacciones ácido-base son reacciones de equilibrio, es decir, los reactivos forman los productos, y los productos reaccionan para volver a formar los reactivos. La reacción se muestra con flechas dobles para indicar que tanto la reacción directa como la inversa ocurren simultáneamente.
Pre-equilibrio y equilibrio
Inicialmente, solo hay reactivos presentes. La concentración de los reactivos disminuye con el tiempo a medida que se convierten en los productos. La velocidad de reacción es proporcional a la concentración de los reactivos. Entonces, la velocidad de la reacción hacia adelante disminuye con el tiempo. Los productos se acumulan con el tiempo. Los productos reaccionan entre sí para volver a formar los reactivos, es decir, la reacción inversa. La velocidad de la reacción inversa aumenta con el tiempo a medida que aumenta la concentración de los productos, hasta que la velocidad de reacción inversa se vuelve igual a la velocidad de la reacción directa, como se ilustra en la Fig. 6.4.1
- Al inicio del equilibrio cuando la velocidad de la reacción inversa es más lenta que la velocidad de reacción directa es la fase de preequilibrio.
- Las fases de equilibrio comienzan en el punto en que la velocidad de reacción inversa se vuelve igual a la velocidad de la reacción directa
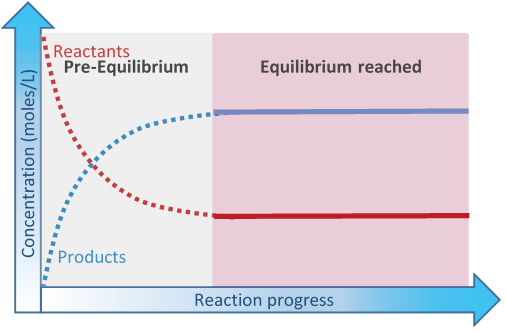
En el punto en que la velocidad de reacción inversa se vuelve igual a la velocidad de la reacción directa, el equilibrio ha alcanzado. La concentración de los reactivos y productos no cambia en equilibrio porque se consumen y se vuelven a formar a la misma velocidad, es un equilibrio dinámico.
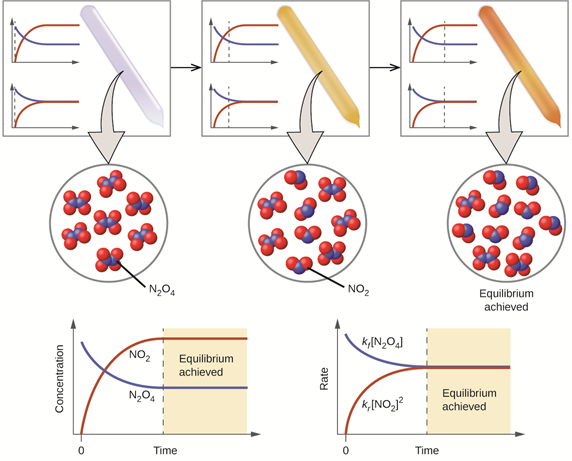
Las reacciones de equilibrio no se limitan a reacciones ácido-base; son comunes en todo tipo de reacciones químicas. La Fig. 6.4.2 ilustra las concentraciones y velocidades de cambios de las reacciones en las fases de preequilibrio y equilibrio con la ayuda de una reacción de equilibrio químico real entre una reacción de descomposición de un gas incoloro N 2 O 4 y su reacción inversa, es decir, una reacción de combinación de color marrón gas NO 2.
¿Qué sucede cuando se altera un equilibrio químico?
La concentración de los reactivos y productos no cambia en la mezcla cuando la reacción está en equilibrio debido a que la velocidad de la reacción directa es igual a la velocidad de la reacción inversa. Cualquier cambio realizado en el equilibrio agrega estrés al equilibrio. El sistema se mueve de una manera para aliviar el estrés. Por ejemplo, si uno de los reactivos se agrega a la mezcla, la velocidad de reacción directa aumenta eliminando el reactivo agregado hasta que se establece un nuevo equilibrio, es decir, el sistema alivia la tensión al eliminar el reactivo agregado.
Si se altera un equilibrio químico, las tasas de reacciones hacia adelante y hacia atrás cambian para aliviar el estrés y restablecer el equilibrio.
Las tensiones pueden ser cambios en la concentración, presión o temperatura, como se explica en la siguiente sección.
Efecto de la concentración sobre un equilibrio químico
Las siguientes son las consecuencias de los cambios de concentración en una reacción química en equilibrio.
- Si se agrega un reactivo, la reacción directa aumenta para eliminar el reactivo.
- Si se elimina un reactivo, la reacción directa disminuye; en consecuencia, la reacción inversa agrega el reactivo.
- Si se agrega un producto, la reacción inversa aumenta para eliminar el producto.
- Si se elimina un producto, la reacción inversa disminuye; en consecuencia, la reacción directa agrega el producto.
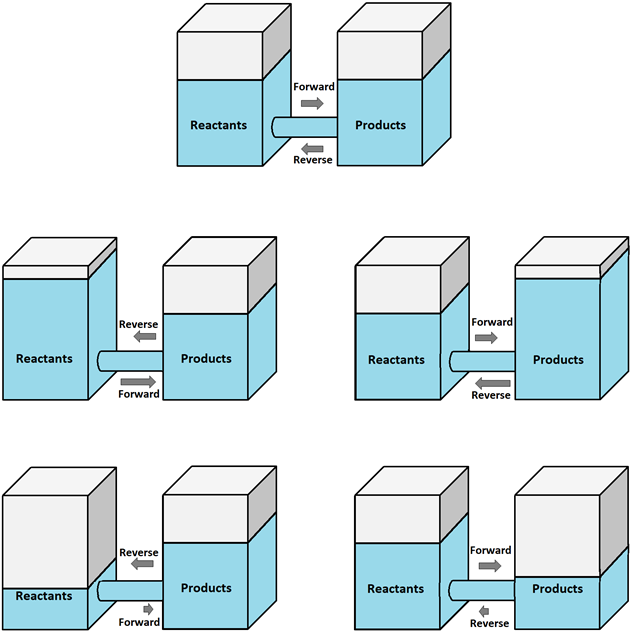
La Fig. 6.4.3 ilustra los efectos con la ayuda del nivel de agua en dos tanques conectados a través de un conducto en el tanque izquierdo que representa los reactivos y en el tanque derecho que representa productos.
La Fig 6.4.4 demuestra el efecto del cambio de concentración sobre el equilibrio químico entre iones dicromato marrón e iones cromato amarillo:



\ begin {ecuación}
\ mathrm {Cr} _ {2}\ mathrm {O} _ {7} ^ {2-} (\ mathrm {aq},\ text {marrón}) +\ mathrm {H} _ {2}\ mathrm {O} (\ mathrm {I})\ rightleftarrows 2\ mathrm {cRO} _ {4} ^ {2-} (\ mathrm {aq}\ texto {, amarillo}) +2\ mathrm {H} ^ {+} (\ mathrm {aq})\ nonumber
\ end {ecuación}
La adición de ácido al tubo de ensayo de la izquierda aumenta H + en el sistema, aumentando la reacción inversa, lo que se puede observar por el aumento de color marrón en el tubo de ensayo medio. Después, la adición de una base elimina H + del sistema mediante una reacción ácido-base:H++OH−→H2O. La disminución en H + desplaza el equilibrio hacia el lado del producto, lo que se puede observar por el aumento del color amarillo en el tubo de ensayo de la derecha.
Un ejemplo práctico del efecto de la concentración en un equilibrio químico es la unión del oxígeno (O 2) con la hemoglobina (Hb) durante el proceso de respiración.
\ begin {ecuación}
\ mathrm {Hb} (\ mathrm {aq}) +\ mathrm {O} _ {2} (\ mathrm {~g})\ rightleftarrows\ mathrm {HbO} _ {2} (\ mathrm {aq})\ nonumber
\ end {ecuación}
La concentración de oxígeno es mayor en las estocadas que desplazan el equilibrio hacia el lado del producto, uniendo más oxígeno con la hemoglobina. Cuando la sangre llega a los tejidos, la concentración de oxígeno es menor en los tejidos, provocando que el equilibrio se desplace hacia el lado reactivo, liberando el oxígeno.
La concentración de oxígeno disminuye a medida que aumenta la altitud. Los alpinistas pueden experimentar hipoxia, es decir, suministro inadecuado de oxígeno al cuerpo debido a que el menor nivel de oxígeno a gran altitud puede desplazar el equilibrio hacia la derecha, resultando en una menor unión de oxígeno con la hemoglobina en los pulmones. El cuerpo reacciona produciendo más hemoglobina, pero el cuerpo tarda unos 10 días en reajustar el nivel de hemoglobina en la sangre. Los pueblos que viven a mayores altitudes suelen tener un mayor nivel de hemoglobina en su sangre por las razones descritas anteriormente.
Efecto de la presión sobre un equilibrio químico
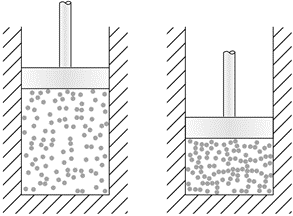
Los cambios en la presión no afectan la concentración de sólidos y líquidos. Sin embargo, un incremento en la presión disminuye el volumen y, en consecuencia, aumenta la concentración de gases, como se ilustra en la Fig. 6.4.5.
Si un equilibrio químico involucra gases, un aumento en la presión tiene el mismo efecto que los aumentos en el reactivo gaseoso o producto, el equilibrio cambia en la dirección donde hay menos moles de gases.
La Fig. 6.4.6 demostró este efecto para el equilibrio entre gas N 2 O 4 incoloro y gas de color marrón NO 2:
\ begin {ecuación}
\ mathrm {N} _ {2}\ mathrm {O} _ {4} (\ mathrm {~g},\ texto {incoloro})\ rightleftarrows 2\ mathrm {NO} _ {2} (\ mathrm {~g},\ texto {marrón})\ nonumber
\ end {ecuación}
El color se vuelve claro al pasar de una jeringa a la derecha a la jeringa en el medio. Se puede explicar con base en que la concentración de gases disminuyó al aumentar el volumen como consecuencia de una disminución de la presión. Entonces el color se vuelve más oscuro con el tiempo, como lo muestra la jeringa de la derecha. El color más oscuro indica que el equilibrio se ha desplazado hacia el lado del producto donde hay más moles de gas, para aliviar el estrés.



Efecto de la temperatura sobre un equilibrio químico
La reacción exotérmica libera calor, es decir, el calor es uno de los productos. Si la reacción directa es exotérmica, la reacción inversa debe ser endotérmica en la misma cantidad y viceversa.
Cuando una reacción reversible en equilibrio se altera al aumentar la temperatura, el equilibrio se desplaza en la dirección endotérmica de la reacción para eliminar el calor y viceversa.
En el equilibrio entre N 2 O 4 incoloros y gases NO 2 de color marrón, la reacción es endotérmica en la dirección hacia adelante:
\ begin {ecuación}
\ mathrm {N} _ {2}\ mathrm {O} _ {4} (g,\ texto {incoloro}) +\ texto {Calor}\ rightleftarrows 2\ mathrm {NO} _ {2} (g,\ texto {marrón})\ nonumber
\ end {ecuación}
Un incremento en la temperatura desplaza el equilibrio en la dirección endotérmica para aliviar el estrés, como se demuestra en la Fig. 6.4.7.



