6.8: Bufferes de pH
( \newcommand{\kernel}{\mathrm{null}\,}\)
¿Qué es un tampón de pH?
Un tampón de pH es una solución acuosa que consiste en un ácido débil y su base conjugada o viceversa que permite que el cambio de pH sea mínimo cuando se le agrega una pequeña cantidad de un ácido fuerte o una base fuerte.
Por ejemplo, la adición de 0.020 mol HCl a 1 L de agua cambia el pH de 7 a 1.7, es decir, aproximadamente un cambio de 80% en el pH. La adición de 0.020 mol de NaOH a la misma agua cambia el pH de 7 a 12.3, es decir, nuevamente, un cambio de aproximadamente 80% en el pH. A diferencia del agua pura, 1 L de solución tampón que contiene 0.50 mol de ácido acético (CH 3 COOH) y 0.50 mol CH 3 COO - -el conjugado del ácido acético, cambia el pH de 4.74 a 4.70 por la adición del mismo 0.020 mol HCl y de 4.74 a 4.77 por la adición de 0.020 mol NaOH, es decir, aproximadamente 1% de cambio en el pH, como se ilustra en la Fig. 6.8.1.
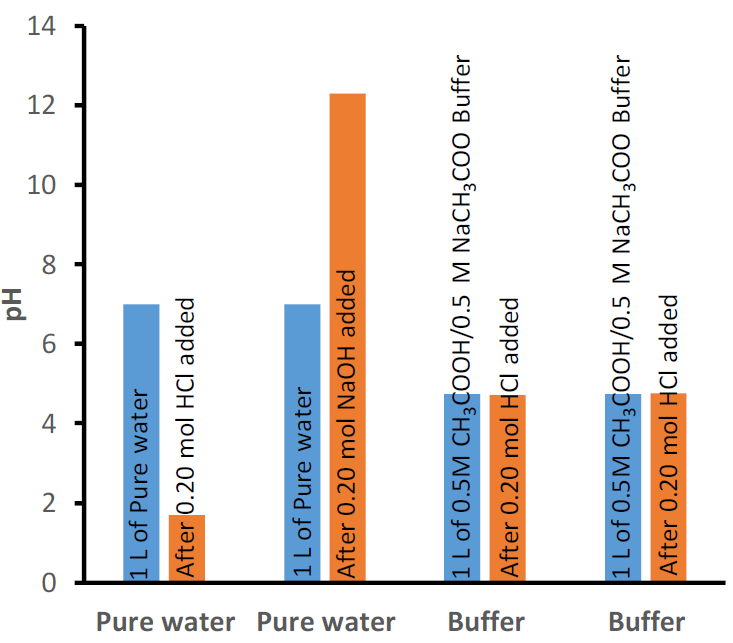
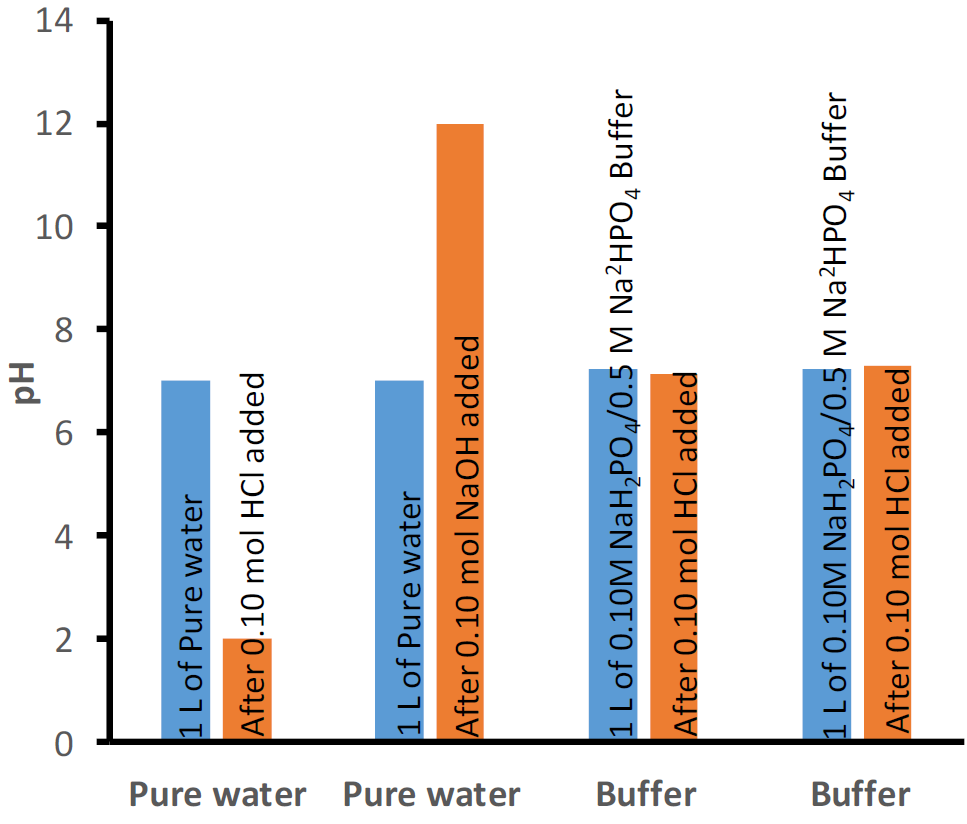
Se pueden preparar tampones de diferentes valores de pH iniciales, por ejemplo, variando la relación del ácido débil a su base conjugada o usando un conjunto diferente de un ácido débil y su base conjugada. Un ejemplo es un tampón de pH inicial 4.74 que comprende ácido acético 0.5 M y acetato de sodio 0.5 M mostrado en la Fig. 6.8.1. Otro ejemplo es un tampón que comprende 0.1M de dihidrogenofosfato y 0.1M de hidrógeno fosfato que tiene un pH inicial de 7.21, como se muestra en la Fig. 6.8.2.
La capacidad de tampón se refiere a la cantidad de un ácido fuerte o una base fuerte que el tampón puede manejar antes de que ocurra un cambio drástico en el pH.
Mayor cantidad de ácido débil/base conjugada mayor la capacidad de tampón. El tampón tiene una cantidad igual de ácido débil y su base conjugada tiene una mayor capacidad de tampón que el mismo tampón que tiene una relación desigual entre el ácido y su base conjugada.
El ácido fuerte y su base conjugada o una base fuerte y su ácido conjugado no hacen una solución tampón.
Mecanismo de acción de búfer
El tampón contiene un ácido débil y su base conjugada en equilibrio. Por ejemplo, el tampón ácido acético/acetato de sodio tiene el siguiente equilibrio.
\ begin {ecuación}
\ mathrm {CH} _ {3}\ mathrm {COOH}\ rightleftarrows\ mathrm {H} ^ {+} +\ mathrm {CH} _ {3}\ mathrm {COO} ^ {-}\ nonumber
\ end {ecuación}
La concentración molar de iones hidrógeno [H +] define el pH de la solución. La base conjugada consume cualquier ácido fuerte agregado.
\ begin {ecuación}
\ mathrm {HA} +\ mathrm {CH} _ {3}\ mathrm {COO} ^ {-}\ fila derecha\ mathrm {CH} _ {3}\ mathrm {COOH} +\ mathrm {A} ^ {-}\ nonumber
\ end {ecuación}
, donde HA es cualquier ácido fuerte y A - es su base conjugada. La concentración de CH 3 COOH aumenta y CH 3 COO - disminuye, pero el pH disminuye pequeño porque [H +] aumenta solo un poco. De igual manera, el ácido débil consume cualquier base fuerte añadida.
\ begin {ecuación}
\ mathrm {MOH} +\ mathrm {CH} _ {3}\ mathrm {COOH}\ rightarrow\ mathrm {CH} _ {3}\ mathrm {COO} ^ {-} +\ mathrm {M} ^ {+} +\ mathrm {H} _ {2}\ mathrm {O}\ nonumber
\ end {ecuación}
Donde MOH es cualquier base fuerte, y M + es su ácido conjugado. La Fig. 6.8.3 ilustra el mecanismo de acción del búfer.
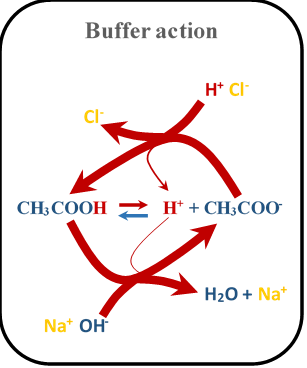
El ácido fuerte y su mezcla base conjugada no tienen acción tampón debido a que el ácido se disocia casi al 100%, sin dejar ningún ácido detrás para la acción del tampón. La base conjugada de un ácido fuerte es una base muy débil que no reacciona con los ácidos añadidos. La misma explicación se aplica a una base fuerte y su mezcla ácida conjugada que no tiene acción tampón.
Buffers en la sangre
La sangre mantiene su pH de ~7.4 principalmente por el sistema de tampón ácido carbónico/carbonato de hidrógeno. El pH de la sangre en el rango de 7.45 a 7.35 se considera saludable, pero fuera de este rango causa problemas médicos. Si el pH de la sangre disminuye a 6.8 o aumenta a 8.0, puede ocurrir la muerte. Es fundamental mantener el pH de la sangre en un rango estrecho para que las células funcionen correctamente. Específicamente, las enzimas y otras proteínas tienen estructuras secundarias, terciarias y cuaternarias necesarias para sus funciones adecuadas. Los enlaces de hidrógeno juegan un papel crucial en la definición de la estructura de la proteína. Los cambios de pH alteran los enlaces de hidrógeno haciendo que las proteínas sean menos efectivas o ineficaces en sus funciones
Los sistemas de tampón regulan el pH de la sangre. El sistema primario de tampón sanguíneo es ácido carbónico/hidrogenocarbonato, como se ilustra en la Fig. 6.8.4. Los procesos metabólicos en las células producen dióxido de carbono (CO 2) que ingresa al torrente sanguíneo y produce ácido carbónico (H 2 CO 3) al reaccionar con agua. Los riñones suministran el hidrogenocarbonato (HCO 3 -) —la base conjugada del ácido carbónico y también mantienen un reservorio del HCO 3 -. El H 2 CO 3 consume cualquier base añadida y el HCO 3 - consume cualquier ácido agregado, minimizando así el cambio de pH debido a los ácidos y bases añadidos.
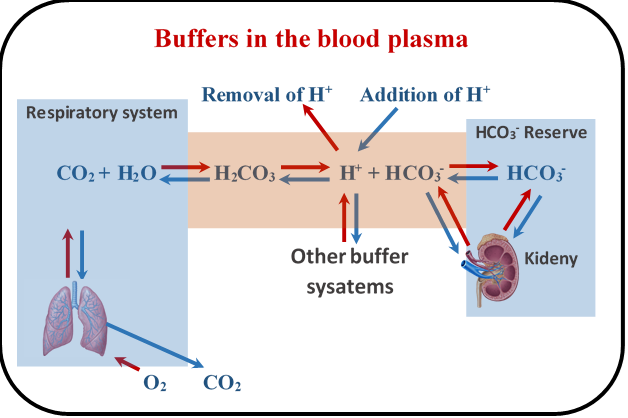
El mecanismo principal para la regulación del pH por el tampón H 2 CO 3/HCO 3 - en la sangre es a través de los pulmones. Cuando el pH de la sangre es ácido comparado con el promedio, la frecuencia respiratoria aumenta exhalando más CO 2 que disminuye la concentración de H +, siguiendo las flechas azules en la Fig. 6.8.4, aumentando el pH. La disminución de la frecuencia respiratoria tiene el efecto contrario. Los riñones también regulan el pH de la sangre agregando o eliminando HCO 3 -, pero la respuesta del riñón se retrasa en comparación con la respuesta de los pulmones.


