6.7: Reacciones ácido-base
( \newcommand{\kernel}{\mathrm{null}\,}\)
Las reacciones ácido-base son reacciones químicas que implican la transferencia de un protón (H +). Los ejemplos incluyen las reacciones de ácidos con metales, carbonatos y bases de Arrhenius, descritas a continuación.
Reacciones de ácidos con metales
Los metales tienden a emitir un electrón y convertirse en cationes. La mayoría de los metales, llamados metales reactivos, emiten electrones a protones en los ácidos y liberan gas H 2. Por ejemplo, la Fig. 6.7.1 muestra magnesio reaccionando con ácido clorhídrico mediante la siguiente reacción:
Mg(s)+2HCl→MgCl2(aq)+H2( g)↑

Los metales alcalinos como Na emiten un electrón, los metales alcalinotérreos como el Mg dan dos electrones, y el aluminio da tres electrones. Un protón puede aceptar un electrón. Por lo tanto, el número de protones ácidos debe ser igual al número de electrones emitidos para equilibrar la transferencia de electrones en estas reacciones.
Los metales nobles o los metales de joyería como el oro, la plata, el platino, el cobre son excepciones, no reaccionan con los ácidos.
escribir una ecuación equilibrada para la reacción del aluminio con HBr?
Solución
Paso 1) escribir la ecuación con las fórmulas correctas de reactivos y productos.
Al(s)+HBr(aq)→AlBr3(aq)+H2( g)
Tenga en cuenta que Al da tres electrones para hacer Al 3 +; es por ello que tres Br - se le unen en el producto para equilibrar la carga.
Paso 2) equilibrar los electrones perdidos por el metal con el número de protones ácidos.
Al(s)+3HBr(aq)→AlBr3(aq)+H2( g)
Paso 3) Equilibrar el resto de los elementos por el método hit y trial. Hay 3 átomos de hidrógeno a la izquierda, equilibrarlos sumando coeficiente 3/2 al hidrógeno de la derecha.
Al(s)+3HBr(aq)→AlBr3(aq)+32H2( g)
Paso 4. Si bien la ecuación está equilibrada, se recomienda eliminar la fracción multiplicando los coeficientes en toda la ecuación por el factor común más alto para obtener la ecuación equilibrada final.
2Al(s)+6HBr(aq)→2AlBr3(aq)+3H2( g)
Reacciones de ácidos con carbonatos e hidrogenocarbonatos
El ácido carbónico (H 2 CO 3) es un ácido débil que se encuentra en el agua carbonatada. El H 2 CO 3 es un producto de dióxido de carbono (CO 2) y agua (H 2 O) por la siguiente reacción de equilibrio.
CO2(aq)+H2O(l)−⇀↽−H2CO3(aq)
El carbonato de hidrógeno (HCO 3 -) y el carbonato (CO 3 2 -) son uno y dos de hidrógeno menos, respectivamente que el ácido carbónico. Las sales que contienen HCO 3 - y CO 3 2 - aceptan uno y dos protones, respectivamente, de ácidos para hacer H 2 CO 3. El H 2 CO 3 se descompone en dióxido de carbono y agua por la reacción inversa mostrada anteriormente. La Fig. 6.7.2 muestra la reacción de hidrogenocarbonato de sodio con ácido clorhídrico.
NaHCO3( s)+HCl(aq)→NaCl(aq)+H2O(I)+CO2( g)↑


Figura6.7.2: La reacción de carbonato de sodio con HCl. Antes y después de la adición de HCl. El dióxido de carbono burbujea tras la adición de HCl. Fuente: NCSSM, 05/18/20, https://youtu.be/TJYOxGHNTzg, CC BY 3.0
De igual manera, el carbonato de calcio que se encuentra en la piedra caliza reacciona Por ejemplo, el ácido sulfúrico es uno de los componentes de la lluvia ácida que reacciona con el carbonato de calcio y daña las esculturas hechas de piedra.
CaCO3( s)+H2SO4(aq)→CaSO4(aq)+H2O(l)+CO2( g)↑
Reacciones de ácidos con bases de Arrhenius
Los ácidos liberan protones (H +) y las bases de Arrhenius liberan iones hidróxido (OH -) en solución. Cuando una mezcla ácida con la base de Arrhenius, los iones H + y OH - reaccionan entre sí y producen moléculas de agua.
H+(aq)+OH−(aq)→H2O(l)
Esta es la ecuación iónica neta de una reacción de un ácido con una base de Arrhenius. El catión de la base y el anión del ácido no reaccionan, son iones espectadores. La ecuación de reacción para una reacción ácido-base está escrita de varias maneras que se explican a continuación.
Ecuación molecular
La ecuación molecular muestra las fórmulas de las sustancias. Por ejemplo, la ecuación molecular de la reacción de HCl con NaOH es la siguiente.
HCl(aq)+NaOH(aq)→NaCl(aq)+H2O(l)
Ecuación iónica completa
La ecuación iónica completa muestra los electrolitos disociados en iones tal como realmente existen en la fase acuosa, es decir, como iones acuosos. La ecuación iónica completa de la reacción de HCl con NaOH es la siguiente.
H+(aq)+Cl−(aq)+Na+(aq)+OH−(aq)→H2O(l)+Na+(aq)+Cl−(aq)
Es evidente que Na + y Cl -no reaccionan- son los iones del espectador.
Ecuación iónica neta
Los iones espectadores están presentes en ambos lados de la ecuación en números iguales. Los iones del espectador pueden ser cancelados, como los términos en una ecuación algebraica.
H+(aq)+Cl−(aq)+Na+(aq)+OH−(aq)→H2O(l)+Na+(aq)+Cl−(aq)
La ecuación iónica neta muestra las sustancias que no son iones espectadores después de cancelar los iones del espectador de la ecuación iónica completa. La ecuación iónica neta de la reacción de HCl con NaOH es la siguiente.
H+(aq)+OH−(aq)→H2O(l)
Todas las reacciones de los ácidos fuertes con bases fuertes de Arrhenius tienen la misma ecuación iónica neta.
Escribir una ecuación química equilibrada de la reacción de ácidos con bases de Arrhenius
El siguiente ejemplo muestra los pasos necesarios para escribir la ecuación equilibrada de la reacción de un ácido con una base de Arrhenius.
Escribir una ecuación química equilibrada de una reacción entre HCl y Ca (OH) 2?
Solución
Paso 1) Escribir la fórmula de ácido y base en los reactivos y sal y agua en los productos. Todos los electrolitos fuertes se disuelven en agua, así que usa (aq) para representar su estado.
HCl(aq)+Ca(OH)2(aq)→ Salt(aq) +H2O(l)
Paso 2) Equilibrar el H + en el ácido con el OH - en la base.
2HCl(aq)+Ca(OH)2(aq)→Salt(aq)+H2O(l)
Paso 3) Equilibrar el H 2 O con el H + en el ácido, o con el OH - en la base.
2HCl(aq)+Ca(OH)2(aq)→ Salt (aq)+2H2O(I)
Paso 4) Escribe la sal peinando los cationes de la base y los aniones del ácido. Asegúrese de que las cargas estén equilibradas en la sal para que sea una sustancia neutra.
2HCl(aq)+Ca(OH)2(aq)→CaCl2(aq)+2H2O(I)
Escribir una ecuación química equilibrada de una reacción entre H 2 SO 4 y Ba (OH) 2?
Solución
Paso 1) Escribir la fórmula de ácido y base en los reactivos y sal y agua en los productos. Todos los electrolitos fuertes se disuelven en agua, así que usa (aq) para representar su estado.
H2SO4(aq)+Ba(OH)2(aq)→Salt(aq)+H2O(l)
Paso 2) Equilibrar el H + en el ácido con el OH - en la base. Ya están equilibrados en la ecuación anterior.
Paso 3) Equilibrar el H 2 O con el H + en el ácido, o con el OH - en la base.
H2SO4(aq)+Ba(OH)2(aq)→Salt(aq)+2H2O(l)
Paso 4) Escribe la sal peinando los cationes de la base y los aniones del ácido. Asegúrese de que las cargas estén equilibradas en la sal para que sea una sustancia neutra.
H2SO4(aq)+Ba(OH)2(aq)→BaSO4(aq)+2H2O(l)
Antiácidos
El estómago a veces produce un exceso de HCl que puede causar acidez estomacal.
Los antiácidos son las sustancias que se utilizan para neutralizar el exceso de HCl en el estómago.

La Fig. 6.7.3 muestra comprimidos antiácidos. Los antiácidos incluyen bases Arrhenius con muy baja solubilidad en agua, como Al (OH) 3, y Mg (OH) 2, o bases débiles como CaCo 2 y NaHCO 3. que reaccionan y neutralizan el ácido:
\ [\ begin {alineado}
&\ mathrm {Al} (\ mathrm {OH}) _ {3} (\ mathrm {~s}) +3\ mathrm {HCl} (\ mathrm {aq})\ rightarrow\ mathrm {AlCl} _ {3} (\ mathrm {aq}) +3\ mathrm {H} _ _ {2}\ mathrm {O} (\ mathrm {l})\\
&\ mathrm {Mg} (\ mathrm {OH}) _ {2} (\ mathrm {~s}) +2\ mathrm {HCl} (\ mathrm {aq})\ fila derecha\ mathrm {MgCl} _ {2} ( \ mathrm {aq}) +2\ mathrm {H} _ {2}\ mathrm {O} (\ mathrm {l})\\
&\ mathrm {CaCo} _ {3} (\ mathrm {~s}) +2\ mathrm {HCl} (\ mathrm {aq})\ fila derecha\ mathrm {CaCl} _ {2} (\ mathrm {aq}) +\ mathrm {H} _ {2}\ mathrm {O} (\ mathrm {I}) +\ mathrm {CO} _ {2} (\ mathrm {~g})\\
&\ mathrm {nahCo} _ {3} (\ mathrm {~s}) +\ mathrm {HCl} (\ mathrm {aq})\ fila derecha\ mathrm {NaCl} (\ mathrm {aq}) +\ mathrm {H} _ {2}\ mathrm {O} (\ mathrm {I}) +\ mathrm {CO} _ {2} (g)
\ end {alineado}\ nonumber\]
Efectos secundarios de los antiácidos
Los antiácidos tienen efectos secundarios, por ejemplo, los antiácidos que contienen aluminio y calcio pueden causar estreñimiento. Los antiácidos que contienen magnesio tienen un efecto laxante. Algunas formulaciones utilizan una mezcla de antiácidos que contienen aluminio y magnesio para cancelar el efecto secundario de cada uno. El antiácido que contiene calcio no se recomienda para personas que tienden a desarrollar cálculos renales, ya que el cálculo renal suele ser una sal de calcio. Los antiácidos que contienen sodio pueden aumentar el nivel de sodio en el líquido corporal y pueden elevar el pH de la sangre.
Titulación ácido-base
La titulación ácido-base es un proceso analítico de determinación de la concentración de ácido, llamado analito, neutralizándolo con una base de concentración conocida, llamada estándar, o viceversa.
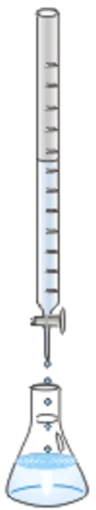
Por lo general, la base está en una bureta y se agrega gota a gota a un volumen conocido del ácido en un matraz Erlenmeyer, como se ilustra en la Fig. 6.7.4. Unas gotas de un indicador ácido-base se mezclan con el ácido. El indicador cambia de color a un rango de pH estrecho específico.
- El punto en el que se ha agregado la cantidad estequiométrica de la base al ácido se denomina punto de equivalencia.
- El punto en el que el indicador cambia de color es el punto final.
Por lo general, el punto de equivalencia es casi el mismo que el punto final.


Los pasos de cálculo después de la titulación suelen ser los siguientes.
- La cantidad, en moles, de la norma se calcula multiplicando la cantidad en litros con la molaridad de la norma.
- Luego, se calcula la cantidad, en moles, del analito, utilizando el factor de conversión mol a mol a partir de la ecuación química equilibrada de la reacción.
- Finalmente, se calcula la molaridad del analito dividiendo los moles por el volumen en litros del analito.
¿Cuál es la molaridad de la solución de HCl si 50.0 mL de la solución de HCl requieren 42.0 mL de solución de NaOH 0.123 M en la titulación?
Solución
Paso 1) Dado:[NaOH]=0.123 M=0.123 mol NaOH1 NaOH
Volume of standard=42.0 mL.=42.0 mL NaOH×1 L NaOH1000 mL NaOH=0.0420 L NaOH
Vol. analyte=50.0 mL=50.0 mL HCl×1 L HCl1000 mL HCl=0.0500 L HCl
Paso 2) Calcular los moles del estándar a partir del volumen y el producto de molaridad.
\ begin {ecuación}
\ texto {Moles de}\ mathrm {~NaOH}\ texto {~consumido} =0.0420\ mathrm {~L}\ mathrm {~NaOH}\ veces\ frac {0.123\ mathrm {~mol}\ mathrm {~NaOH}} {1\ mathrm {~L}\ mathrm {~NaOH}} =0.00517\ mathrm {~mol} {}\ mathrm {~NaOH}\ nonumber
\ fin {ecuación}
Paso 3) escribir la ecuación química equilibrada de la reacción.
\ begin {ecuación}
\ mathrm {HCl} (\ mathrm {aq}) +\ mathrm {NaOH} (\ mathrm {aq})\ rightarrow\ mathrm {NaCl} (\ mathrm {aq}) +\ mathrm {H} _ _ {2}\ mathrm {O} (\ mathrm {l})\ nonumber\
\ end {ecuación}
Paso 4) escribir el factor de conversión para mol de patrón a mol de cálculo de analito a partir de la ecuación.
\ begin {ecuación}
\ frac {1\ texto {mol}\ mathrm {~HCl}} {1\ mathrm {~mol}\ mathrm {~NaOH}}\ nonumber
\ end {ecuación}
Paso 5) Calcular los moles del analito multiplicando los moles del patrón y el factor de conversión.
\ begin {ecuación}
0.00517\ mathrm {~mol}\ mathrm {~NaOH}\ veces\ frac {1\ mathrm {~mol}\ mathrm {~HCl}} {1\ mathrm {~mol}\ mathrm {~NaOH}} =0.00517\ mathrm {~mol} {}\ mathrm {~HCl}\ nonumber
\ end {ecuación}
Paso 6) Calcular la molaridad del analito dividiendo los moles con el volumen en litros del analito.
\ begin {ecuación}
0.00517\ mathrm {~mol}\ mathrm {~NaOH}\ veces\ frac {1\ mathrm {~mol}\ mathrm {~HCl}} {1\ mathrm {~mol}\ mathrm {~NaOH}} =0.00517\ mathrm {~mol} {}\ mathrm {~HCl}\ nonumber
\ end {ecuación}
Después de aprender los pasos a fondo, los cálculos se pueden hacer en unos pocos pasos, como se muestra a continuación.
Cálculos:42.0 mL NaOH×1 L NaOH1000 mL NaOH×0.123 mol NaOH1 L NaOH×1 mol HCl1 mol NaOH=0.00517 mol HCl
Molaridad de HCl:M=n(mol)V(L)=0.00517 mol HCl50.0 mL HCl×1000 mL HCl1 L HCl=0.103 M HCl
¿Cuál es la molaridad de la solución H 2 SO 4 si 50.0 mL de la solución H 2 SO 4 requieren 32.3 mL de solución de NaOH 0.201 M en la titulación?
Solución
Paso 1) Dado:\ begin {ecuación}
\ begin {alineado}
& {[\ mathrm {NaOH}] =0.201\ mathrm {~M} =\ frac {0.201\ mathrm {~mol}\ mathrm {~NaOH}} {1\ mathrm {~L}\ mathrm {~NaOH}}}\\
&\ text {Vol.standard} =42.0\ mathrm {~mL} =32.3\ mathrm {~mL}\ mathrm {~NaOH}\ veces\ frac {1\ mathrm {~L }\ mathrm {~NaOH}} {1000\ mathrm {~mL}\ mathrm {~NaOH}} =0.0323\ mathrm {~L}\ mathrm {~NaOH}\\
&\ text {Vol. analito} =50,0\ mathrm {~mL} =50,0\ mathrm {~ml~HCl}\ veces\ frac {1\ mathrm {~L}\ mathrm {~l}\ mathrm {HCl}} {1000\ mathrm {~mL}\ mathrm {~HCl}} =0.0500\ mathrm {~L}\ mathrm {~HCl}
\ final {alineado}\ nonumber
\ end {ecuación}
Paso 2) Calcular los moles del estándar a partir del volumen y el producto de molaridad.
\ begin {ecuación}
\ texto {Moles de}\ mathrm {~NaOH}\ texto {consumido} =0.0323\ mathrm {~N}\ mathrm {~NaOH}\ veces\ frac {0.201\ mathrm {~mol}\ mathrm {~NaOH}} {1\ mathrm {~L}\ mathrm {~NaOH}} =0.00649\ texto {~mol} {~NaOH}\ nonumber
\ end {ecuación}
Paso 3) escribir la ecuación química equilibrada de la reacción.
\ begin {ecuación}
\ mathrm {H} _ {2}\ mathrm {SO} _ {4} (\ mathrm {aq}) +2\ mathrm {NaOH} (\ mathrm {aq})\ fila derecha\ mathrm {Na} _ {2}\ mathrm {SO} _ {4} (\ mathrm {aq}) +2\ mathrm {H} _ {2}\ mathrm {O} (\ mathrm {l})\ nonumber
\ end {ecuación}
Paso 4) escribir el factor de conversión para los moles de estándar a mol de cálculo de analito a partir de la ecuación.
\ begin {ecuación}
\ frac {1\ mathrm {~mol}\ mathrm {~H} _ {2}\ mathrm {SO} _ {4}} {2\ mathrm {~mol}\ mathrm {~NaOH}}\ nonumber
\ end {ecuación}
Paso 5) Calcular los moles del analito multiplicando los moles del patrón y el factor de conversión.
\ begin {ecuación}
0.00649\ texto {mol}\ mathrm {~NaOH}\ veces\ frac {1\ mathrm {~mol}\ mathrm {~H} _ {2}\ mathrm {SO} _ {4}} {2\ mathrm {~mol}\ mathrm {~NaOH}} =0.00325\ mathrm {~mol}\ mathrm {~H} _ {2} SO} _ {4}\ nonumber
\ end {ecuación}
Paso 6) Calcular la molaridad del analito dividiendo los moles con el volumen en litros del analito.
\ begin {ecuación}
\ text {Concentración de}\ mathrm {~H} _ {2}\ mathrm {SO} _ {4} =\ frac {0.00325\ mathrm {~mol}\ mathrm {~H} _ {2}\ mathrm {SO} _ {4}} {0.0500\ mathrm {~L}\ mathrm {~H} _ _ {2}\ mathrm {SO} _ {4}} =0.0649\ mathrm {~M} {~H_ {2}} SO_ {4}\ nonumber
\ fin {ecuación}
El mismo cálculo en forma de resumen se encuentra en el siguiente.
Concentration of H2SO4=0.00325 mol H2SO40.0500 L H2SO4=0.0649 M H2SO4
Moles of H2SO4=32.3 mL NaOH×1 L NaOH1000 mL NaOH×0.201 mol NaOH1 L NaOH×1 mol H2SO42 mol NaOH=0.00326 mol H2SO4
Molarity of H2SO4:M=n( mol)V(L)=0.00326 mol H2SO450.0 mL H2SO4×1000 mL H2SO41 L H2SO4=0.0649 M H2SO4


