1.1: Las mediciones importan
- Page ID
- 77483
Resultados de aprendizaje
- Demostrar el uso de la notación científica.
- Identificar unidades base y derivadas para mediciones.
- Memorizar los prefijos métricos, abreviaturas y valores (Tablas 1.1.1 y 1.1.3).
- Convierte entre temperaturas en Celsius y Fahrenheit.
Muchos aspectos de la química utilizan mediciones cuantitativas para describir el comportamiento. En esta sección, veremos cómo tratamos con números muy grandes o muy pequeños, unidades de medida y prefijos utilizados con estas unidades, y cómo se reportan los números.
Notación Científica
La notación científica es una forma de expresar los números como producto de dos números: un coeficiente y el número 10 elevado a una potencia. Es una herramienta muy útil para trabajar con números que son o bien muy grandes o muy pequeños. A modo de ejemplo, la distancia de la Tierra al Sol es de unos 150,000,000,000 metros, una distancia muy grande de hecho. En notación científica, la distancia se escribe como\(1.5 \times 10^{11} \: \text{m}\). El coeficiente es el 1.5 y debe ser un número mayor o igual a 1 e inferior a 10. El poder de 10, o exponente, es 11 porque tendrías que multiplicar 1.5 por\(10^{11}\) para obtener el número correcto. La notación científica a veces se denomina notación exponencial.
Cuando se trabaja con números pequeños, utilizamos un exponente negativo. Entonces 0.1 metros es\(1 \times 10^{-1}\) metros, 0.01 es\(1 \times 10^{-2}\) y así sucesivamente. Un glóbulo rojo tiene un diámetro de 0.000008 metros lo cual no es conveniente escribir ni decir. Es mucho más fácil reportar un diámetro de\(8 \times 10^{-6} \: \text{m}\). El uso de la notación científica es una forma de hacer que escribir números muy grandes o muy pequeños sea más conveniente. Tenga en cuenta el uso de un cero inicial (el cero a la izquierda del punto decimal) al escribir números muy pequeños. El cero inicial está ahí para ayudarte a ver el punto decimal con más claridad. La cifra 0.01 es menos probable que se malinterprete que .01 donde es posible que no veas el punto decimal.
Unidades
Unidades Base SI
Todas las mediciones dependen del uso de unidades que son todas bien conocidas y entendidas. El sistema inglés de unidades de medida (pulgadas, pies, onzas, etc.) no se utilizan en la ciencia debido a la dificultad de convertir de una unidad a otra. El sistema métrico se utiliza porque todas las unidades métricas se basan en múltiplos de 10, haciendo que las conversiones sean muy simples. El sistema métrico se estableció originalmente en Francia en 1795. El Sistema Internacional de Unidades es un sistema de medición basado en el sistema métrico. El acrónimo SI se usa comúnmente para referirse a este sistema y significa el término francés, Le Système International d'Unités. El SI fue adoptado por acuerdo internacional en 1960 y está integrado por siete unidades base, cinco de las cuales se muestran en la tabla siguiente. Si bien algunas de las unidades base tienen un cálculo como su estándar, el kilogramo tiene un estándar físico pero hay un movimiento para cambiar eso. Lea o escuche más sobre los cambios a la norma en http://www.npr.org/templates/story/s...ryId=112003322.
| Cantidad | Unidad Base SI | Símbolo |
|---|---|---|
| Largo | medidor | \(\text{m}\) |
| Masa | kilogramo | \(\text{kg}\) |
| Temperatura | kelvin | \(\text{K}\) |
| Tiempo | segundo | \(\text{s}\) |
| Cantidad de una Sustancia | mole | \(\text{mol}\) |
Estas cinco unidades se encuentran frecuentemente en la química y otras unidades de medida, como el volumen, la fuerza y la energía, se pueden derivar de las unidades base SI.

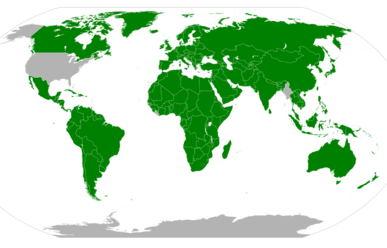
El mapa de la siguiente figura muestra la adopción de las unidades SI en países de todo el mundo. Estados Unidos ha adoptado legalmente el sistema métrico para las mediciones, pero no lo utiliza en la práctica cotidiana. Gran Bretaña y gran parte de Canadá utilizan una combinación de unidades métricas e imperiales.
Unidades Derivadas
Algunas unidades son combinaciones de unidades base SI. Una unidad derivada es una unidad que resulta de una combinación matemática de unidades base SI. Estas unidades derivadas son el estándar para estas cantidades pero no siempre son las unidades utilizadas en la práctica normal. Por ejemplo, la densidad de un sólido o un líquido a menudo se reporta como\(\text{g/cm}^3\), o más\(\text{g/mL}\) bien que\(\text{kg/m}^3\) (la unidad SI derivada). Algunos ejemplos comunes de unidades derivadas se enumeran en la siguiente tabla.
| Cantidad | Símbolo | Unidad | Abreviatura de unidades | Derivación |
|---|---|---|---|---|
| Área | \(A\) | metro cuadrado | \(\text{m}^2\) | \(\text{length} \times \text{width}\) |
| Volumen | \(V\) | metro cúbico | \(\text{m}^3\) | \(\text{length} \times \text{width} \times \text{height}\) |
| Densidad | \(D\) | kilogramos/metro cúbico | \(\text{kg/m}^3\) | \(\frac{\text{mass}}{\text{volume}}\) |
| Concentración | \(c\) | moles/litro | \(\text{mol/L}\) | \(\frac{\text{amount}}{\text{volume}}\) |
| Velocidad (velocidad) | \(v\) | metros/segundo | \(\text{m/s}\) | \(\frac{\text{length}}{\text{time}}\) |
| Aceleración | \(a\) | metros/segundo/segundo | \(\text{m/s}^2\) | \(\frac{\text{speed}}{\text{time}}\) |
| Fuerza | \(F\) | newton | \(\text{N}\) | \(\text{mass} \times \text{acceleration}\) |
| Energía | \(E\) | joule | \(\text{J}\) | \(\text{force} \times \text{length}\) |
Prefijos métricos
Las conversiones entre unidades métricas del sistema son sencillas porque el sistema se basa en potencias de diez. Por ejemplo, los metros, centímetros y milímetros son todas unidades métricas de longitud. Hay 10 milímetros en 1 centímetro y 100 centímetros en 1 metro. Los prefijos métricos se utilizan para distinguir entre unidades de diferente tamaño. Todos estos prefijos derivan de términos latinos o griegos. Por ejemplo, mega viene de la palabra griega\(\mu \epsilon \gamma \alpha \varsigma\), que significa “genial”.
La siguiente tabla enumera los prefijos métricos más comunes y su relación con la unidad base que no tiene prefijo. La longitud se utiliza como ejemplo para demostrar el tamaño relativo de cada unidad prefijada. Sin embargo, estos prefijos se pueden usar con cualquier unidad base.
| Prefijo | Abreviatura de unidades | Significado | Ejemplo |
|---|---|---|---|
| giga | \(\text{G}\) | 1,000,000,000 | 1 Gigámetro\(\left( \text{Gm} \right) = 10^9 \: \text{m}\) |
| mega | \(\text{M}\) | 1,000,000 | 1 megametro\(\left( \text{Mm} \right) = 10^6 \: \text{m}\) |
| kilo | \(\text{k}\) | 1,000 | 1 kilómetro\(\left( \text{km} \right) = 1,000 \: \text{m}\) |
| 1 | 1 metro\(\left( \text{m} \right)\) | ||
| deci | \(\text{d}\) | 1/10 | 1 decímetro\(\left( \text{dm} \right) = 0.1 \: \text{m}\) |
| centi | \(\text{c}\) | 1/100 | 1 centímetro\(\left( \text{cm} \right) = 0.01 \: \text{m}\) |
| milli | \(\text{m}\) | 1/1,000 | 1 milímetro\(\left( \text{mm} \right) = 0.001 \: \text{m}\) |
| micro | \(\mu\) | 1/1,000,000 | 1 micrómetro\(\left( \mu \text{m} \right) = 10^{-6} \: \text{m}\) |
| nano | \(\text{n}\) | 1/1,000,000,000 | 1 nanómetro\(\left( \text{nm} \right) = 10^{-9} \: \text{m}\) |
*Micro a menudo se abrevia “mc” en el cuidado de la salud para evitar confusiones entre el\(\mu\) y m, que a menudo se ven similares cuando se escribe a mano.
Hay más prefijos, algunos de ellos raramente utilizados, que van mucho más allá de lo que aquí se da. ¿Alguna vez has oído hablar de un zeptómetro? Puedes obtener más información sobre los prefijos en http://www.bipm.org/en/measurement-units/
Dado que el sistema métrico no es el sistema de unidades habitual que usamos, puede ser difícil comprender el tamaño relativo de cada unidad. Vaya a http://learn.genetics.utah.edu/content/cells/scale y use el control deslizante debajo de la imagen para hacer zoom y ver cómo se comparan los tamaños de los objetos.
Hay un par de pequeñas prácticas extrañas con el uso de abreviaturas unitarias. La mayoría de las abreviaturas son minúsculas. Utilizamos "\(\text{m}\)" para medidor y no "\(\text{M}\)”. No obstante, cuando se trata de volumen, la unidad base “litro” se abrevia como "\(\text{L}\)" y no "\(\text{l}\)”. Entonces escribiríamos 3.5 mililitros como\(3.5 \: \text{mL}\).
Como cuestión práctica, siempre que sea posible se deben expresar las unidades en un número pequeño y manejable. Si estás midiendo el peso de un material que pesa\(6.5 \: \text{kg}\), esto es más fácil que decir que pesa\(6500 \: \text{g}\). Ambos son correctos, bu las\(\text{kg}\) unidades en este caso hacen para un número pequeño y de fácil manejo.
Básculas de Temperatura
Hay tres escalas de temperatura que se utilizan comúnmente en la medición. Sus unidades son\(^\text{o} \text{F}\) (grados Fahrenheit),\(^\text{o} \text{C}\) (grados Celsius) y\(\text{K}\) (Kelvin). La escala Fahrenheit, que es la escala más utilizada en los Estados Unidos, define el punto de congelación normal y el punto de ebullición del agua como\(32^\text{o} \text{F}\) y\(212^\text{o} \text{F}\), respectivamente. La escala Celsius define el punto de congelación normal y el punto de ebullición del agua como\(0^\text{o} \text{C}\) y\(100^\text{o} \text{C}\), respectivamente. La escala Celsius se usa comúnmente en la mayoría de los países del mundo. La escala Kelvin, que también se conoce como la escala de temperatura absoluta, define el cero absoluto como la temperatura teóricamente más baja posible, lo que significa que las temperaturas expresadas en Kelvin no pueden ser números negativos.
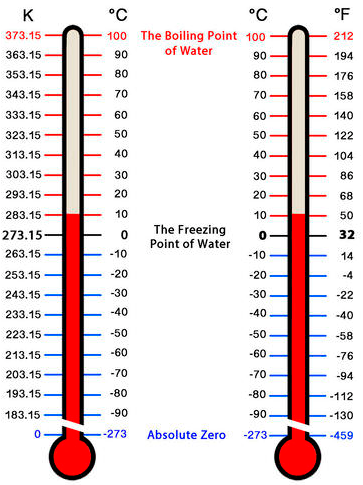
Conversión de Escalas de Temperatura
Independientemente de la escala de temperatura utilizada, es importante poder convertir de una escala a otra. Aquí están las conversiones que utilizamos.
\(^\text{o} \text{F}\)a\(^\text{o} \text{C}\)
\[T_{^\text{o} \text{C}} = \left( T_{^\text{o} \text{F}} - 32 \right) \times \frac{5}{9}\]
\(^\text{o} \text{C}\)a\(^\text{o} \text{F}\)
\[T_{^\text{o} \text{F}} = \frac{9}{5} \times \left( T_{^\text{o} \text{C}} \right) + 32\]
\(^\text{o} \text{C}\)a\(\text{K}\)
\[T_\text{K} = T_{^\text{o} \text{C}} + 273.15\]
\(\text{K}\)a\(^\text{o} \text{C}\)
\[T_{^\text{o} \text{C}} = T_\text{K} - 273.15\]
Ejemplo\(\PageIndex{1}\)
El punto de fusión del mercurio es\(-38.84^\text{o} \text{C}\). Convierte este valor a grados Fahrenheit y Kelvin.
Solución
Las fórmulas anteriores se pueden utilizar para convertir entre unidades de temperatura. Primero, el valor dado se puede utilizar para convertir de\(^\text{o} \text{C}\) a\(^\text{o} \text{F}\).
\[\begin{align*} T_{^\text{o} \text{F}} &= \frac{9}{5} \times \left( -38.84^\text{o} \text{C} \right) + 32 & \\ T_{^\text{o} \text{F}} &= -37.91^\text{o} \text{F} & \end{align*}\]
Entonces, se puede usar la misma temperatura inicial para encontrar la temperatura en Kelvin.
\[\begin{align*} T_\text{K} &= -38.84^\text{o} \text{C} + 273.15 & \\ T_\text{K} &= 234.75 \: \text{K} & \end{align*}\]
Recursos Suplementarios
- Práctica de notación científica: http://www.mathisfun.com/numbers/sci... -notation.html
- Historia de las Unidades SI: http://physics.nist.gov/cuu/Units/history.html
Colaboradores y Atribuciones
CK-12 Foundation by Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson, and Jean Dupon.
Allison Soult, Ph.D. (Department of Chemistry, University of Kentucky)

