4.1: Estructuras de punto de electrones de Lewis
- Page ID
- 77373
Resultados de aprendizaje
- Determinar la estructura de Lewis de un compuesto.
Las sustancias iónicas se mantienen completamente unidas por enlaces iónicos. Las cargas completas de los iones (por ejemplo,\(\ce{Na^+}\) y\(\ce{Cl^-}\) en cloruro de sodio) provocan interacciones electrostáticas que dan como resultado una red cristalina estable. Los compuestos iónicos existen como arreglos extendidos y ordenados de iones. Esto es bastante diferente de la estructura de las sustancias moleculares, que toman la forma de colecciones de moléculas individuales.
Los electrones que forman un enlace covalente no están completamente poseídos por un solo átomo (como serían los electrones en un ion) sino que se comparten entre los dos átomos involucrados en el enlace. El concepto del enlace covalente fue propuesto por primera vez en 1916 por el químico estadounidense G. N. Lewis (1875 - 1946), quien sugirió que compartir electrones era una forma en que los átomos podían alcanzar un octeto completo de electrones de valencia. Esta idea fue ampliada por Linus Pauling (1901 - 1994), quien finalmente ganó el Premio Nobel de Química en 1954 por su trabajo sobre la unión química.
Enlaces Covalentes Individuales
El enlace covalente más simple se forma entre dos átomos de hidrógeno. Cada átomo de hidrógeno tiene un solo electrón, y cada uno necesita dos electrones para una capa externa completa. La molécula de hidrógeno,\(\ce{H_2}\), consiste en dos átomos de hidrógeno que comparten sus dos electrones de valencia. El hidrógeno también puede formar enlaces covalentes con otros átomos. Por ejemplo, el hidrógeno y el cloro necesitan cada uno un electrón más para lograr una configuración de gas noble. Al compartir electrones de valencia (cada átomo dona uno), se forma la\(\ce{HCl}\) molécula estable.
Utilizaremos una representación simplificada de enlaces covalentes conocidos como estructuras de Lewis. Estos dibujos también son conocidos por varios otros nombres, incluyendo estructuras de puntos de Lewis o estructuras de puntos electrónicos. Cada punto en la estructura representa un electrón de valencia en el compuesto. Por ejemplo,\(\ce{H_2}\) podría dibujarse como\(\ce{H} : \ce{H}\). Cada punto representa un electrón de valencia, y el hecho de que estén colocados entre los dos átomos significa que están siendo compartidos como un enlace covalente. Para moléculas más grandes, puede resultar engorroso extraer todos los electrones de valencia, por lo que un par de electrones de unión también se puede dibujar como una línea recta. Así, también se\(\ce{H_2}\) puede representar como\(\ce{H-H}\).
Si quisiéramos mostrar la estructura de Lewis de\(\ce{HCl}\), dibujaríamos lo siguiente:

Podemos ver que el enlace covalente consiste en dos electrones entre el\(\ce{H}\) y el\(\ce{Cl}\). El\(\ce{H}\) tiene una capa externa completa de dos electrones y el cloro tiene una capa externa completa de ocho electrones. Los enlaces covalentes con otros halógenos se pueden escribir de la misma manera.
Se pueden escribir tipos similares de estructuras de Lewis para otras moléculas que forman enlaces covalentes. Muchos compuestos que contienen\(\ce{O}\),\(\ce{N}\),\(\ce{C}\),\(\ce{S}\), y\(\ce{P}\) se mantienen unidos por enlaces covalentes. El número de enlaces covalentes que formará un átomo generalmente se puede predecir por el número de electrones que un átomo requiere para llenar su capa de valencia. Por ejemplo, el oxígeno tiene 6 electrones en su capa externa y necesita dos más para llenar esta capa, por lo que sólo formará dos enlaces covalentes con otros átomos. Si nos fijamos en la molécula de agua\(\left( \ce{H_2O} \right)\) (ver figura abajo), vemos que el átomo de oxígeno hace dos enlaces totales (uno con cada átomo de hidrógeno).
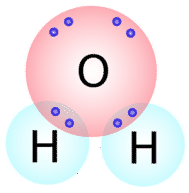
Como puede ver, hay dos pares de electrones no involucrados en el enlace covalente. Estos pares de electrones no unidos se conocen como pares solitarios y contribuyen a la forma general de la molécula. Del mismo modo, el nitrógeno necesita tres electrones para completar su capa de valencia, por lo que tiende a formar tres enlaces covalentes, con un solo par de electrones no enlazantes sobrantes.
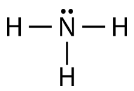
Nuevamente, cada una de las líneas representa un par de electrones de unión (un enlace sencillo), y el par solitario de nitrógeno se dibuja como dos puntos.
Doble y Triple Bonos
Hasta el momento hemos considerado únicamente enlaces simples, formados por el reparto de un electrón de cada átomo. Muchas moléculas contienen dobles enlaces, en los que cada átomo comparte dos electrones, o triples enlaces, en los que cada átomo comparte tres electrones. Estos se representan dibujando dos o tres líneas entre los átomos unidos. Por ejemplo, un doble enlace carbono-carbono se puede escribir como\(\ce{C} :: \ce{C}\) o\(\ce{C=C}\). Se muestra un triple enlace carbono-carbono como\(\ce{C ::: C}\) o con tres líneas entre los dos átomos de carbono, como se ve en la estructura de una molécula orgánica llamada acetileno (mostrada en la figura a continuación). Así como\(\ce{N}\) quiere formar 3 enlaces, otros elementos tienden a formar el mismo número de enlaces en diferentes compuestos.

Construiremos estructuras de Lewis que satisfagan la regla del octeto para determinar cómo se unen los átomos entre sí utilizando los componentes que se muestran en la tabla a continuación para crear estructuras que siguen la regla del octeto.
Tabla\(\PageIndex{1}\): Componentes para construir estructuras de Lewis

Recursos Suplementarios
Practica dibujo Lewis Dot Estructuras de Compuestos Covalentes: http://www.wisc-online.com/objects/V...spx? ID=GCH6404
Colaboradores y Atribuciones
CK-12 Foundation by Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson, and Jean Dupon.
Allison Soult, Ph.D. (Department of Chemistry, University of Kentucky)

