4.2: Representando estructuras
- Page ID
- 77391
Resultados de aprendizaje
- Utilice fórmulas estructurales condensadas para representar moléculas.
- Usar estructuras esqueléticas para representar moléculas.
Las estructuras de Lewis son excelentes para moléculas pequeñas pero pueden complicarse cuando se trata de moléculas grandes. Hay una variedad de formas en las que podemos representar moléculas que proporcionan uso con suficiente información sin crear una figura complicada. Las estructuras de la siguiente figura representan todas las moléculas pentano, que es un alcano de cadena lineal con cinco átomos de carbono.

Estructuras de Lewis
La estructura de Lewis muestra enlaces para representar el intercambio de electrones e incluir todos los átomos en la molécula por lo que tenemos información sobre la conectividad de los átomos pero no la forma molecular o geometría.
Modelo de llenado de espacios
Un modelo de relleno de espacio tridimensional muestra la conectividad de los átomos y la forma de la molécula. Estos funcionan bien para moléculas más pequeñas, pero pueden ser un desafío de interpretar ya que los átomos están muy cerca entre sí. Esta es la representación más precisa de cómo se ve una molécula.
Estructura esquelética
Estas son la forma más sencilla de representar la estructura de una molécula. Los átomos de hidrógeno se omiten (excepto cuando están unidos a\(\ce{O}\) o\(\ce{S}\)) y los átomos de carbono están en la intersección de cada par de líneas y en el extremo terminal de cada línea. Cada uno de los círculos de la siguiente figura indica dónde se encuentra un carbono.

Estructuras Condensadas
Estos proporcionan más información que una fórmula química (como\(\ce{C_5H_{12}}\) para el pentano) pero se condensan tal como lo da su nombre, por lo que pueden escribirse en lugar de en un dibujo. La mejor manera de escribir una estructura condensada es “leer” una estructura de Lewis y ver cómo están conectados los átomos.
Ejemplo\(\PageIndex{1}\)
Dibujar la estructura esquelética y condensada del 2-butanol en base a la estructura de Lewis dada.

Estructura esquelética
Contar el número de átomos de carbono y dibujar la cadena de carbono con el número correcto de átomos de carbono. Esto representa una cadena de cuatro átomos de carbono.

Ahora busca cualquier átomo que no sea hidrógeno que esté unido a la cadena de carbono. El segundo carbono tiene un\(\ce{-OH}\) grupo. Agrega eso al segundo carbono de la cadena.
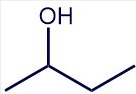
La estructura esquelética es completa y todos los átomos de hidrógeno restantes están implícitos porque cada carbono debe tener cuatro enlaces.
Estructura condensada
Para la estructura condensada, “leemos” la estructura de Lewis de izquierda a derecha.
El primer carbono tiene tres átomos de hidrógeno unidos por lo que comenzamos con
\[\ce{CH_3}\]
El segundo carbono tiene un hidrógeno unido y un\(\ce{-OH}\) grupo. Como el\(\ce{-OH}\) grupo está a un lado, lo ponemos entre paréntesis
\[\ce{CH_3CH(OH)}\]
El tercer carbono tiene dos átomos de hidrógeno unidos por lo que añadimos\(\ce{CH_2}\)
\[\ce{CH_3CH(OH)CH_2}\]
El cuarto, y último, el carbono tiene tres átomos de hidrógeno unidos, por lo que agregamos\(\ce{CH_3}\)
\[\ce{CH_3CH(OH)CH_2CH_3}\]
El resultado es la estructura condensada del 2-butanol.
Colaboradores y Atribuciones
CK-12 Foundation by Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson, and Jean Dupon.
Allison Soult, Ph.D. (Department of Chemistry, University of Kentucky)

