10.3: Vida media
- Page ID
- 77417
Resultados de aprendizaje
- Definir la vida media en relación con los nucleidos radiactivos y resolver problemas de semivida.
- Describir el proceso general por el cual se utiliza la datación radiactiva para determinar la edad de diversos objetos.
- Calcular el tiempo de decaimiento de una muestra.
- Cálculos completos de dosis basados en la actividad de los nucleidos.
La tasa de desintegración radiactiva a menudo se caracteriza por la vida media de un radioisótopo.. La vida media\(\left( t_{1/2} \right)\) es el tiempo requerido para que la mitad de los núcleos de una muestra de material radiactivo se descomponen. Después de que haya pasado cada vida media, la mitad de los núcleos radiactivos se habrán transformado en un nuevo nucleido (ver tabla a continuación). La tasa de decaimiento y la vida media no dependen del tamaño original de la muestra. Tampoco dependen de factores ambientales como la temperatura y la presión.
| Número de vidas medias superadas | Fracción restante | Porcentaje restante | Masa restante comenzando con\(80 \: \text{g}\) |
|---|---|---|---|
| 1 | 1/2 | 50 | \ (80\:\ text {g}\)” style="vertical-align:middle; text-align:center; ">\(40 \: \text{g}\) |
| 2 | 1/4 | 25 | \ (80\:\ text {g}\)” style="vertical-align:middle; text-align:center; ">\(20 \: \text{g}\) |
| 3 | 1/8 | 12.5 | \ (80\:\ text {g}\)” style="vertical-align:middle; text-align:center; ">\(10 \: \text{g}\) |
| 4 | 1/16 | 6.25 | \ (80\:\ text {g}\)” style="vertical-align:middle; text-align:center; ">\(5.0 \: \text{g}\) |
| 5 | 1/32 | 3.125 | \ (80\:\ text {g}\)” style="vertical-align:middle; text-align:center; ">\(2.5 \: \text{g}\) |
Como ejemplo, el yodo-131 es un radioisótopo con una vida media de 8 días. Se descompone por emisión de partículas beta en xenón-131.
\[\ce{^{131}_{53}I} \rightarrow \ce{^{131}_{54}Xe} + \ce{^0_{-1}e}\]
Pasados ocho días, la mitad de los átomos de cualquier muestra de yodo-131 habrán decaído, y ahora la muestra será\(50\%\) yodo-131 y\(50\%\) xenón-131. Después de que pasen otros ocho días (un total de 16 días o 2 vidas medias), la muestra será\(25\%\) yodo-131 y\(75\%\) xenón-131. Esto continúa hasta que toda la muestra de yodo-131. ha decaído completamente (ver figura abajo).
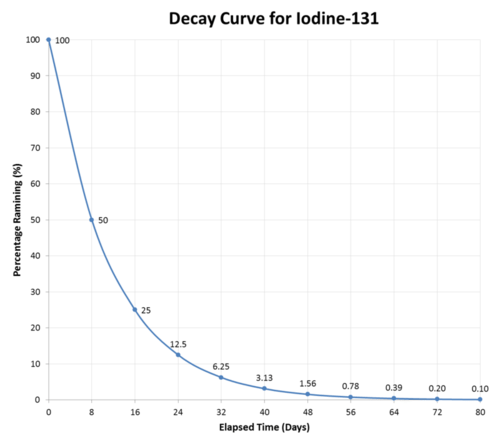
Las vidas medias tienen un rango muy amplio, desde miles de millones de años hasta fracciones de segundo. A continuación se enumeran las vidas medias de algunos radioisótopos comunes e importantes. Aquellos con vidas medias en la escala de horas o días son los más adecuados para su uso en el tratamiento médico.
El siguiente ejemplo ilustra cómo usar la vida media de una muestra para determinar la cantidad de radioisótopo que queda después de que haya pasado un cierto período de tiempo.
Ejemplo\(\PageIndex{1}\): Strontium-90
El estroncio-90 tiene una vida media de 28.1 días. Si comienzas con una\(5.00 \: \text{mg}\) muestra del isótopo, ¿cuánto queda después de que hayan pasado 140.5 días?
Solución
Paso 1: Enumere los valores conocidos y planifique el problema.
Conocido
- Masa original\(= 5.00 \: \text{mg}\)
- \(t_{1/2} =\)28.1 días
- Tiempo transcurrido\(=\) 140.5 días
Desconocido
- Masa final de\(\ce{Sr}\) -90\(= ? \: \text{mg}\)
Primero, encontrar el número de semividas que han pasado dividiendo el tiempo transcurrido por la vida media. Después, reducir la cantidad de\(\ce{Sr}\) -90 a la mitad, una vez por cada vida media.
Paso 2: Resolver.
Número de vidas medias, días, masa
0 vidas medias, 0 días,\(5.00 \: \text{mg}\)
1 vida media, 28.1 días,\(2.50 \: \text{mg}\)
2 vidas medias, 56.2 días,\(1.25 \: \text{mg}\)
3 vidas medias, 84.3 días,\(0.613 \: \text{mg}\)
4 semividas, 112.4 días,\(0.313 \: \text{mg}\)
5 vidas medias, 140.5 días,\(0.156 \: \text{mg}\)
Paso 3: Piensa en tu resultado.
De acuerdo con los datos anteriores, el paso de 5 medias vidas medias\(0.156 \: \text{mg}\) del original\(\ce{Sr}\) -90 permanece. El resto\(4.844 \: \text{mg}\) se ha descompuesto por emisión de partículas beta a itrio-90.
Datación radiactiva
La datación radiactiva es un proceso mediante el cual se determina la edad aproximada de un objeto mediante el uso de ciertos núclidos radiactivos. Por ejemplo, el carbono-14 tiene una vida media de 5,730 años y se utiliza para medir la edad del material orgánico. La proporción de carbono-14 a carbono-12 en los seres vivos permanece constante mientras el organismo está vivo porque el carbono-14 fresco ingresa al organismo cada vez que consume nutrientes. Cuando el organismo muere, este consumo se detiene, y no se agrega nuevo carbono-14 al organismo. A medida que pasa el tiempo, la proporción de carbono-14 a carbono-12 en el organismo disminuye gradualmente, debido a que el carbono-14 se descompone radioactivamente mientras que el carbono-12 es estable. El análisis de esta proporción permite a los arqueólogos estimar la edad de los organismos que estaban vivos hace muchos miles de años. La datación por carbono es efectiva hasta aproximadamente 50,000 años. Las edades de muchas rocas y minerales son mucho mayores que las edades de los fósiles. Los minerales que contienen uranio que han sido analizados de manera similar han permitido a los científicos determinar que la Tierra tiene más de 4 mil millones de años.
Serie Decay
En muchos casos, la desintegración de un nucleido radiactivo inestable simplemente produce otro nucleido radiactivo. Puede tomar varios pasos sucesivos para llegar a un nucleido que sea estable. Una serie de desintegración es una secuencia de desintegraciones radiactivas sucesivas que procede hasta que se alcanza un nucleido estable. Los términos reactante y producto generalmente no se usan para reacciones nucleares. En cambio, los términos nucleido padre e hija se utilizan para referirse a los isótopos de inicio y finalización en un proceso de desintegración. La siguiente figura muestra la serie de decaimiento para uranio-238.
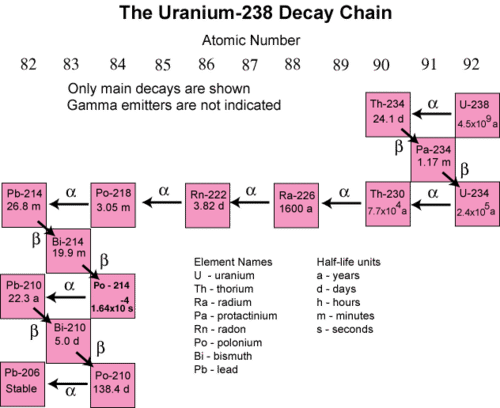
En el primer paso, el uranio-238 decae por emisión alfa a torio-234 con una vida media de\(4.5 \times 10^9\) años. Esto disminuye su número atómico en dos. El torio-234 decae rápidamente por emisión beta a protactinio-234 (\(t_{1/2} =\)24.1 días). El número atómico aumenta en uno. Esto continúa por muchos más pasos hasta que finalmente la serie termina con la formación del isótopo estable plomo-206.
Transmutación Artificial
Como hemos visto, la transmutación ocurre cuando los átomos de un elemento se descomponen espontáneamente y se convierten en átomos de otro elemento. La transmutación artificial es el bombardeo de núcleos estables con partículas cargadas o no cargadas para provocar una reacción nuclear. Las partículas bombardeadoras pueden ser protones, neutrones, partículas alfa o átomos más grandes. Ernest Rutherford realizó algunos de los primeros bombardeos, incluido el bombardeo de gas nitrógeno con partículas alfa para producir el isótopo inestable de flúor 18.
\[\ce{^{14}_7N} + \ce{^4_2He} \rightarrow \ce{^{18}_9F}\]
Fluorine-18 se descompone rápidamente al nucleido estable oxígeno-17 al liberar un protón.
\[\ce{^{18}_9F} \rightarrow \ce{^{17}_8O} + \ce{^1_1H}\]
Cuando el berilio-9 es bombardeado con partículas alfa, el carbono-12 se produce con la liberación de un neutrón.
\[\ce{^9_4Be} + \ce{^4_2He} \rightarrow \ce{^{12}_6C} + \ce{^1_0n}\]
Elementos de Transuranio
Muchos, muchos radioisótopos que no ocurren naturalmente han sido generados por transmutación artificial. Se han producido los elementos tecnecio y prometio, ya que estos elementos ya no ocurren en la naturaleza. Todos sus isótopos son radiactivos y tienen vidas medias lo suficientemente cortas como para que cualquier cantidad de los elementos que alguna vez existieron haya desaparecido hace mucho tiempo a través de la desintegración natural. Los elementos transuránicos son elementos con números atómicos mayores a 92. Todos los isótopos de estos elementos son radiactivos y ninguno ocurre naturalmente.
Dosificación
Los cálculos de la vida media pueden basarse en la masa, el porcentaje restante o la dosis. Independientemente de cuál, el concepto sigue siendo el mismo. Comprender la radiactividad y la vida media de una muestra es importante para calcular la dosis correcta para un paciente y determinar los niveles y la duración de la emisión radiactiva de un paciente después de recibir el tratamiento.
Frecuentemente, las dosis de isótopos radiactivos reciben la actividad en volumen. Por ejemplo, la concentración de\(\ce{I}\) -137 se da como\(50 \: \mu \text{Ci/mL}\) (MicroCurie por mililitro). Esta relación se puede utilizar para calcular el volumen necesario para una dosis particular. Por ejemplo, un paciente necesita\(125 \: \mu \text{Ci}\) de\(\ce{I}\) 1-51. ¿Qué volumen de\(50 \mu \text{Ci}\) una\(10 \: \text{mL}\) solución se debe dar?
\[125 \: \mu \text{Ci} \left( \frac{10 \: \text{mL}}{50 \: \mu \text{Ci}} \right) = 25 \: \text{mL}\]
Ejemplo\(\PageIndex{2}\)
A un paciente se le administra\(\ce{I}\) -131 para tratar el cáncer de tiroides. El paciente recibe\(5.50 \: \text{mL}\) de una solución que contiene\(50 \: \text{mCi}\) (MilliCurie) en\(2 \: \text{mL}\) (supongamos que la concentración es un número exacto). ¿Qué hace (in\(\text{mCi}\)) se le da al paciente? ¿Cuál será la actividad en\(\text{mCi}\) después de 24.21 días dado que la vida media de\(\ce{I}\) -131 es de 8.07 días?
Solución
La primera parte del problema es encontrar la dosis que se le da al paciente. Se nos da el volumen y la concentración (en unidades de radiactividad sobre volumen).
\[5.50 \: \text{mL solution} \left( \frac{50 \: \text{mCi}}{2 \: \text{mL}} \right) = 138 \: \text{mCi}\]
Al paciente se le da una dosis de\(138 \: \text{mCi}\).
Ahora, necesitamos encontrar la actividad después de que hayan pasado 24.21 días. Después de una vida media (8.07 días), la muestra tendrá la mitad de actividad\(\left( 138/2 = 69.0 \: \text{mCi} \right)\). Después de dos semividas (total de 16.14 días), la muestra tendrá la mitad de actividad que después de la primera vida media\(\left( 69.0/2 = 34.5 \: \text{mCi} \right)\). Después de tres semividas (total de 24.21 días), la muestra tendrá la mitad de actividad que después de la segunda vida media\(\left( 34.5/2 = 17.3 \: \text{mCi} \right)\). Por lo tanto, después de 24.21 días (3 semividas), la radiactividad será\(17.3 \: \text{mCi}\).
Colaboradores y Atribuciones
CK-12 Foundation by Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson, and Jean Dupon.
Allison Soult, Ph.D. (Department of Chemistry, University of Kentucky)

