10.4: Cambios Físicos y Químicos
- Page ID
- 77443
Resultados de aprendizaje
- Distinguir entre cambios físicos y químicos.
- Dar ejemplos de cambios físicos y químicos.
Cambios Físicos
A medida que un cubito de hielo se derrite, su forma cambia a medida que adquiere la capacidad de fluir. Sin embargo, su composición no cambia. La fusión es un ejemplo de un cambio físico. Un cambio físico es un cambio a una muestra de materia en la que cambian algunas propiedades del material, pero la identidad de la materia no. Los cambios físicos pueden clasificarse además como reversibles o irreversibles. El cubito de hielo derretido puede ser recongelado, por lo que fundir es un cambio físico reversible. Los cambios físicos que implican un cambio de estado son todos reversibles. Otros cambios de estado incluyen vaporización (líquido a gas), congelación (líquido a sólido) y condensación (gas a líquido). Disolver es también un cambio físico reversible. Cuando la sal se disuelve en agua, se dice que la sal ha entrado en estado acuoso. La sal puede ser recuperada por ebullición del agua, dejando atrás la sal.

Cuando un trozo de madera se muele para convertirlo en aserrín, ese cambio es irreversible ya que el aserrín no pudo reconstituirse en la misma pieza de madera que era antes. Cortar el pasto o pulverizar una roca serían otros cambios físicos irreversibles. La leña también representa un cambio físico irreversible ya que las piezas no se pueden volver a juntar para formar el árbol.

Cambios Químicos
Cuando se expone al aire, un objeto hecho de hierro eventualmente comenzará a oxidarse (ver figura a continuación).

A medida que el óxido se forma en la superficie del hierro, se descascara para exponer más hierro, que continuará oxidándose. El óxido es claramente una sustancia que es diferente del hierro. La oxidación es un ejemplo de un cambio químico.
Una propiedad química describe la capacidad de una sustancia para sufrir un cambio químico específico. Una propiedad química del hierro es que es capaz de combinarse con el oxígeno para formar óxido de hierro, el nombre químico de óxido. Un término más general para la oxidación y otros procesos similares es la corrosión. Otros términos que se usan comúnmente en las descripciones de los cambios químicos son quemar, pudrirse, explotar y fermentar. Las propiedades químicas son muy útiles como forma de identificar sustancias. Sin embargo, a diferencia de las propiedades físicas, las propiedades químicas solo se pueden observar ya que la sustancia se encuentra en proceso de transformarse en una sustancia diferente.
Un cambio químico también se llama reacción química. Una reacción química es un proceso que ocurre cuando una o más sustancias se transforman en una o más sustancias nuevas. \(\left( \ce{Zn} \right)\)El zinc es un elemento gris plateado que se puede moler en polvo. Si el zinc se mezcla a temperatura ambiente con azufre en polvo\(\left( \ce{S} \right)\), un elemento amarillo brillante, el resultado será simplemente una mezcla de zinc y azufre. No se produce ninguna reacción química. Sin embargo, si se proporciona energía a la mezcla en forma de calor, el zinc reaccionará químicamente con el azufre para formar el compuesto sulfuro de zinc\(\left( \ce{ZnS} \right)\). A continuación se muestran las sustancias involucradas en esta reacción.
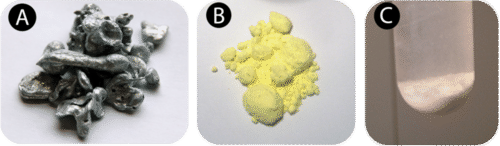
La reacción entre zinc y azufre se puede representar en algo llamado ecuación química. En palabras, podríamos escribir la reacción como:
\[\text{zinc} + \text{sulfur} \rightarrow \text{zinc sulfide}\]
Una forma más conveniente de expresar una reacción química es usar los símbolos y fórmulas de las sustancias involucradas:
\[\ce{Zn} + \ce{S} \rightarrow \ce{ZnS}\]
La (s) sustancia (s) a la izquierda de la flecha en una ecuación química se denominan reactivos. Un reactivo es una sustancia que está presente al inicio de una reacción química. La (s) sustancia (s) a la derecha de la flecha se denominan productos. Un producto es una sustancia que está presente al final de una reacción química. En la ecuación anterior, el zinc y el azufre son los reactivos que se combinan químicamente para formar sulfuro de zinc como producto.
Reconocer reacciones químicas
¿Cómo se puede saber si se está produciendo una reacción química? Ciertas pistas visuales indican que es probable (pero no necesariamente) una reacción química, incluyendo los siguientes ejemplos:
- Se produce un cambio de color durante la reacción.
- Se produce un gas durante la reacción.
- En la reacción se produce un producto sólido, llamado precipitado.
- Una transferencia visible de energía se produce en forma de luz como resultado de la reacción.
Cuando el zinc reacciona con el ácido clorhídrico, la reacción burbujea vigorosamente a medida que se produce gas hidrógeno (ver figura a continuación). La producción de un gas también es una indicación de que puede estar ocurriendo una reacción química.

Cuando se agrega una solución incolora de nitrato de plomo (II) a una solución incolora de yoduro de potasio, se produce instantáneamente un sólido amarillo llamado precipitado (ver figura abajo). Un precipitado es un producto sólido que se forma a partir de una reacción y se deposita de una mezcla líquida. La formación de un precipitado también puede indicar la ocurrencia de una reacción química.
\[\ce{Pb(NO_3)_2} \left( aq \right) + 2 \ce{KI} \left( aq \right) \rightarrow \ce{PbI_2} \left( s \right) + 2 \ce{KNO_3} \left( aq \right)\]

Colaboradores y Atribuciones
CK-12 Foundation by Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson, and Jean Dupon.
Allison Soult, Ph.D. (Department of Chemistry, University of Kentucky)

