11.2: La naturaleza de la oxidación y reducción
- Page ID
- 77582
Resultados de aprendizaje
- Definir la oxidación y reducción en términos de ganancia o pérdida de átomos de oxígeno o hidrógeno.
- Definir la oxidación y reducción en términos de ganancia o pérdida de electrones.
- Identificar las sustancias involucradas en la oxidación y reducción en una reacción.
- Identificar los agentes oxidantes y reductores en una reacción redox.
- Escribir la secuencia de oxidación o reducción de una molécula (alcohol, aldehído/cetona, ácido carboxílico)
El oxígeno es un elemento que se conoce desde hace siglos. En su forma elemental pura, el oxígeno es altamente reactivo y produce fácilmente compuestos con la mayoría de los demás elementos. También es el elemento más abundante por masa en la corteza terrestre. La clase de reacciones llamadas oxidación y reducción se definieron originalmente con respecto al elemento oxígeno.
El papel del oxígeno en las reacciones
Muchos elementos simplemente se combinan con el oxígeno para formar el óxido de ese elemento. Calentar el magnesio en el aire le permite combinarse con el oxígeno para formar óxido de magnesio.
\[2 \ce{Mg} \left( s \right) + \ce{O_2} \left( g \right) \rightarrow 2 \ce{MgO} \left( s \right)\]
Muchos compuestos también reaccionan con el oxígeno, a menudo en procesos muy exotérmicos que generalmente se denominan reacciones de combustión. Por ejemplo, cuando se quema metano, se produce dióxido de carbono y agua.
\[\ce{CH_4} \left( g \right) + 2 \ce{O_2} \left( g \right) \rightarrow \ce{CO_2} \left( g \right) + 2 \ce{H_2O} \left( g \right)\]
El dióxido de carbono es un óxido de carbono, mientras que el agua es un óxido de hidrógeno. Los primeros científicos vieron la oxidación como un proceso en el que una sustancia reaccionaba con oxígeno para producir uno o más óxidos. En los ejemplos anteriores, el magnesio y el metano están siendo oxidados.
La oxidación no requiere necesariamente calentamiento. El hierro que se expone al aire y al agua se oxida lentamente en un proceso comúnmente conocido como oxidación. Los blanqueadores contienen diversos compuestos como el hipoclorito de sodio\(\left( \ce{NaClO} \right)\) que puede oxidar las manchas por la transferencia de átomos de oxígeno, haciendo que las moléculas en las manchas sean más solubles en agua y por lo tanto más fáciles de enjuagar. El peróxido de hidrógeno\(\left( \ce{H_2O_2} \right)\) libera oxígeno a medida que se descompone espontáneamente. También actúa como lejía y es ued como antiséptico que mata las bacterias al oxidarlas.
Lo opuesto a la oxidación se llama reducción. Dado que la oxidación se definió originalmente como la adición de oxígeno, la reducción fue por lo tanto la eliminación de oxígeno de una sustancia. Muchos minerales metálicos naturales están presentes como óxidos. Los metales puros pueden ser extraídos por reducción. Por ejemplo, el hierro puro se obtiene a partir del óxido de hierro (III) haciéndolo reaccionar con carbono a altas temperaturas.
\[2 \ce{Fe_2O_3} \left( s \right) + 3 \ce{C} \left( s \right) \rightarrow 4 \ce{Fe} \left( s \right) + 3 \ce{CO_2} \left( g \right)\]
La eliminación de oxígeno de la\(\ce{Fe_2O_3}\) molécula significa que se está reduciendo a\(\ce{Fe}\). Tenga en cuenta que un proceso de oxidación también está ocurriendo simultáneamente en esta reacción; el reactivo de carbono está siendo oxidado a\(\ce{CO_2}\). Este es un concepto importante. Al observar los compuestos orgánicos, podemos describir la oxidación y reducción en términos de la pérdida o ganancia de oxígeno o la pérdida o ganancia de hidrógeno.
Si observamos la oxidación del etanol (\(\ce{CH_3CH_2OH}\), un alcohol) para formar etanal (\(\ce{CH_3CH_2CHO}\), un aldehído), vemos que el número de enlaces al oxígeno ha aumentado y el número de átomos de hidrógeno ha disminuido de seis a cuatro. Cualquiera o ambos de estos indican que se ha producido una oxidación.

Para una reducción, buscamos la eliminación de oxígeno o enlaces al oxígeno o la adición o átomos de hidrógeno. En la siguiente reacción, vemos que el ácido etanoico (\(\ce{CH_3COOH}\), un ácido carboxílico) se reduce a etanal (\(\ce{CH_3CH_2CHO}\), un aldehído). Tenga en cuenta que el número de átomos de oxígeno se reduce de dos a uno. No hay cambio en el número de átomos de hidrógeno, pero ambos cambios no necesitan ocurrir para evidencia de oxidación o reducción.

Si vemos evidencia de una oxidación o reducción, sabemos que la otra debió haber sucedido también. La oxidación y la reducción deben ocurrir juntas. Tampoco puede suceder solo en una reacción.
El electrón en las reacciones redox
Las definiciones de oxidación y reducción finalmente se ampliaron para incluir tipos similares de reacciones que no necesariamente involucran oxígeno. El oxígeno es más electronegativo que cualquier elemento excepto el flúor. Por lo tanto, cuando el oxígeno está unido a cualquier elemento que no sea flúor, los electrones del otro átomo se desplazan alejándose de ese átomo y hacia el átomo de oxígeno. Una reacción de oxidación-reducción (a veces abreviada como reacción redox) es una reacción que implica la transferencia total o parcial de electrones de un reactivo a otro. La oxidación implica una pérdida total o parcial de electrones, mientras que la reducción implica una ganancia total o parcial de electrones.
Un dicho fácil para recordar las definiciones de oxidación y reducción es “LEO el león dice GER” (ver figura abajo)! LEO significa Perder electrones es oxidación, mientras que GER significa Ganar electrones es reducción.

Reacciones Redox y Compuestos Iónicos
En el curso de una reacción química entre un metal y un no metal, los electrones se transfieren de los átomos metálicos a los átomos no metálicos. Por ejemplo, cuando el zinc metálico se calienta en presencia de azufre, se produce el compuesto sulfuro de zinc (ver figura a continuación). Dos electrones de valencia de cada átomo de zinc se transfieren a cada átomo de azufre.
Dado que el zinc está perdiendo electrones durante esta reacción, se está oxidando. El azufre está ganando electrones, por lo que se está reduciendo. Cada uno de estos procesos se puede mostrar en una ecuación separada llamada media reacción. Una semi-reacción es una ecuación que muestra la reacción de oxidación o reducción que se produce durante una reacción redox.
\[\begin{align} &\text{Oxidation:} \: \: \ce{Zn} \rightarrow \ce{Zn^{2+}} + 2 \ce{e^-} \\ &\text{Reduction:} \: \: \ce{S} + 2 \ce{e^-} \rightarrow \ce{S^{2-}} \end{align}\]
Es importante recordar que las dos medias reacciones ocurren simultáneamente. Los iones resultantes que se forman son luego atraídos entre sí, formando un enlace iónico.
Las reacciones redox también se describen comúnmente en términos de agentes oxidantes y reductores. En la reacción anterior, el zinc está siendo oxidado al perder electrones. Sin embargo, una ionización aislada sería un proceso de muy alta energía, por lo que debe haber otra sustancia presente para ganar esos electrones perdidos. En este caso, los electrones son ganados por el azufre. En otras palabras, el azufre está provocando que el zinc sea oxidado. En consecuencia, el azufre es referido como el agente oxidante. Por el contrario, el zinc hace que el azufre gane electrones y se reduzca, por lo que el zinc es el agente reductor. Un agente oxidante es una sustancia que causa oxidación al aceptar electrones, y un agente reductor es una sustancia que causa reducción al perder electrones. Dicho de otra manera, el agente oxidante es la sustancia que se reduce, mientras que el agente reductor es la sustancia que se oxida.
Ejemplo\(\PageIndex{1}\)
Cuando se burbujea gas cloro en una solución de bromuro de sodio, se produce una reacción que produce cloruro de sodio acuoso y bromo elemental.
- Determinar qué se está oxidando y qué se está reduciendo.
- Identificar los agentes oxidantes y reductores.
Solución
Primero, observe cada elemento en la reacción y asigne números de oxidación a cada elemento.
\[\ce{Cl_2} \left( g \right) + 2 \ce{NaBr} \left( aq \right) \rightarrow 2 \ce{NaCl} \left( aq \right) + \ce{Br_2} \left( l \right)\]
El cloro en\(\ce{Cl_2}\) y el bromo en\(\ce{Br_2}\) ambos tienen números de oxidación de 0. \(\ce{NaBr}\)y\(\ce{NaCl}\) son compuestos iónicos por lo que sus cargas iónicas serán sus números de oxidación.
\[\overset{0}{\ce{Cl_2}} \left( g \right) + 2 \overset{+1}{\ce{Na}} \overset{-1}{\ce{Br}} \left( aq \right) \rightarrow 2 \overset{+1}{\ce{Na}} \overset{-1}{\ce{Cl}} \left( aq \right) + \overset{0}{\ce{Br_2}} \left( l \right)\]
a. El estado de oxidación del cloro va de 0 a\(-1\) por lo que está ganando un electrón y siendo reducido. El estado de oxidación del bromo va de\(-1\) a 0 por lo que está perdiendo un electrón y siendo oxidado. El estado de oxidación del sodio no cambia por lo que no está involucrado ni en la oxidación ni en la reducción.
b. El\(\ce{Cl_2}\) se está reduciendo y es el agente oxidante. El\(\ce{Br^-}\) está siendo oxidado y es el agente reductor.

Reacciones Redox y Compuestos Moleculares
La pérdida o ganancia de electrones es fácil de ver en una reacción en la que se forman iones. Sin embargo, en muchas reacciones, los electrones no se transfieren completamente. Recordemos que en un compuesto molecular, los electrones se comparten entre átomos en un tipo de enlace llamado enlace covalente. Aunque los electrones no se transfieren completamente entre los átomos, todavía es común que las reacciones que involucran compuestos moleculares se clasifiquen como reacciones redox.
Por ejemplo, cuando se hace reaccionar gas hidrógeno con gas oxígeno, se forma agua como producto.
\[2 \ce{H_2} \left( g \right) + \ce{O_2} \left( g \right) \rightarrow 2 \ce{H_2O} \left( l \right)\]
Asignamos números de oxidación para determinar qué especies están ganando y perdiendo electrones. Recuerde que los números de oxidación nos dicen cuál sería la carga si los electrones fueran transferidos completamente a pesar de que se comparten, no se transfieren, en enlaces covalentes. Para la síntesis del agua, los números de oxidación de los elementos libres (hidrógeno y oxígeno) son cero. Para el agua, el oxígeno tiene un número de\(-2\) oxidación mientras que el hidrógeno tiene un\(+1\).
\[2 \overset{0}{\ce{H_2}} \left( g \right) + \overset{0}{\ce{O_2}} \left( g \right) \rightarrow 2 \overset{+1}{\ce{H_2}} \overset{-2}{\ce{O}} \left( l \right)\]
El estado de oxidación a partir del hidrógeno va de 0 a\(+1\), indicando oxidación. El estado de oxidación del oxígeno va de 0 a\(-2\), lo que indica reducción. Por lo tanto, el hidrógeno se oxida y es el agente reductor. El oxígeno se reduce y es el agente oxidante.
Ganancia o pérdida de hidrógeno y oxígeno
La oxidación también se puede definir como la adición de oxígeno a una molécula o la eliminación de hidrógeno. Por lo tanto, la reducción es la adición de hidrógeno o la eliminación de oxígeno. Varias clases de compuestos orgánicos están relacionadas entre sí por reacciones de oxidación y reducción. Los alcanos, alquenos y alquinos representan diferentes niveles de oxidación de un hidrocarburo. Cuando un alcano se calienta en presencia de un catalizador apropiado, se puede oxidar al alqueno correspondiente en una reacción llamada reacción de deshidrogenación. Dos átomos de hidrógeno se eliminan en el proceso. El alqueno se puede oxidar adicionalmente a un alquino mediante la eliminación de dos átomos de hidrógeno más. Esto también se considera una oxidación según la definición moderna, debido a que el número de oxidación de cada átomo de carbono va de\(-3\) a\(-2\) a\(-1\).
\[\text{oxidation:} \: \: \ce{CH_3CH_3} \overset{\ce{-H_2}}{\rightarrow} \ce{CH_2=CH_2} \overset{\ce{-H_2}}{\rightarrow} \ce{CH \equiv CH}\]
Las reacciones son reversibles, por lo que un alquino puede reducirse primero a un alqueno y luego a un alcano. Se trata de reacciones de adición, como se vio en el apartado anterior.
\[\text{reduction:} \: \: \ce{CH \equiv CH} \overset{\ce{+H_2}}{\rightarrow} \ce{CH_2=CH_2} \overset{\ce{+H_2}}{\rightarrow} \ce{CH_3CH_3}\]
El alcano es la forma más reducida de un hidrocarburo, mientras que el alquino es la forma más oxidada.
Los cambios en los electrones, el número de oxidación, el número de átomos de oxígeno y el número de átomos de hidrógeno se resumen a continuación para las reacciones de oxidación y reducción.
Las reacciones de oxidación en la química orgánica a menudo implican la adición de oxígeno a un compuesto (o un aumento en el número de enlaces al oxígeno), lo que cambia el grupo funcional que está presente. La siguiente secuencia muestra cómo el metano se puede oxidar primero a metanol (alcohol), luego a metanal (aldehído), luego a ácido metanoico (ácido carboxílico) y finalmente a dióxido de carbono. Cada paso en el proceso es una ganancia de oxígeno o una pérdida de hidrógeno. Cada paso también representa energía, lo que explica por qué la combustión completa de alcanos a dióxido de carbono es una reacción extremadamente exotérmica.
\[\begin{array}{ccccccccc} \ce{CH_4} & \overset{\text{gain of oxygen}}{\rightarrow} & \ce{CH_3OH} & \overset{\text{loss of hydrogen}}{\rightarrow} & \ce{CH_2O} & \overset{\text{gain of oxygen}}{\rightarrow} & \ce{HCOOH} & \overset{\text{loss of hydrogen}}{\rightarrow} & \ce{CO_2} \\ \text{alkane} & & \text{alcohol} & & \text{aldehyde} & & \text{carboxylic acid} & & \text{carbon dioxide} \end{array}\]
El proceso opuesto es la reducción de un ácido carboxílico a un alcano que implica la pérdida de oxígeno y la ganancia de hidrógeno.
\[\begin{array}{ccccccc} \ce{CH_4} & \overset{\text{loss of oxygen}}{\leftarrow} & \ce{CH_3OH} & \overset{\text{gain of hydrogen}}{\leftarrow} & \ce{CH_2O} & \overset{\text{loss of oxygen}}{\leftarrow} & \ce{HCOOH} \\ \text{alkane} & & \text{alcohol} & & \text{aldehyde} & & \text{carboxylic acid} \end{array}\]
La oxidación de un alcohol puede producir ya sea un aldehído o una cetona. Un alcohol primario oxidado para formar un aldehído.
\[\ce{CH_3CH_2OH} \underset{\ce{H^+}}{\overset{\ce{Cr_2O_7^{2-}}}{\rightarrow}} \ce{CH_3CHO}\]
Un alcohol secundario se oxida a una cetona en lugar de a un aldehído. La oxidación del alcohol secundario más simple, el 2-propanol, produce propanona.
\[\ce{CH_3CHOHCH_3} \underset{\ce{H^+}}{\overset{\ce{Cr_2O_7^{2-}}}{\rightarrow}} \ce{CH_3COCH_3}\]
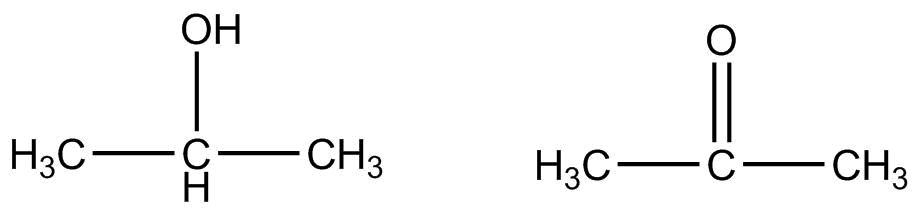
Los alcoholes terciarios no pueden oxidarse de esta manera porque el carbono al que está unido el grupo hidroxilo no tiene otro átomo de hidrógeno unido a él y no puede sufrir oxidación.
Cuando un alcohol primario se oxida a un aldehído en presencia de agua, la reacción puede ser difícil de detener porque el aldehído se puede oxidar adicionalmente al ácido carboxílico correspondiente. Por ejemplo, la oxidación del etanal produce ácido etanoico (acético). Las bebidas que contienen etanol como el vino son susceptibles a dicha oxidación si se mantienen durante largos períodos de tiempo después de haber sido abiertas y expuestas al aire. El vino que se ha oxidado tendrá un desagradable sabor vinegario debido a la producción de ácido acético. A diferencia de los aldehídos, las cetonas son resistentes a la oxidación adicional debido a que el grupo carbonilo se encuentra en la mitad de la cadena carbonada, por lo que la cetona no se puede convertir en un ácido carboxílico.
\[\ce{CH_3CHO} \underset{\ce{H^+}}{\overset{\ce{Cr_2O_7^{2-}}}{\rightarrow}} \ce{CH_3COOH}\]
| Proceso | Cambios en los electrones (siempre) | Cambio en el número de oxidación (siempre) | Cambio en el oxígeno (algunas reacciones) | Cambio en el hidrógeno (algunas reacciones) |
|---|---|---|---|---|
| Oxidación | perder | aumentar | ganancia | perder |
| Reducción | ganancia | disminuir | perder | ganancia |

Colaboradores y Atribuciones
CK-12 Foundation by Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson, and Jean Dupon.
Allison Soult, Ph.D. (Department of Chemistry, University of Kentucky)




