2.6: Estructura Electrónica de Átomos
- Page ID
- 73390
Objetivos de aprendizaje
- Describir cómo los electrones se agrupan dentro de los átomos en conchas, subconchas y orbitales usando números cuánticos.
Ahora se sabe que la tabla periódica se organiza en grupos y periodos (columnas y filas) en función de las propiedades químicas y físicas de los diferentes elementos. El primer elemento, hidrógeno (Z =1) tiene un protón y un electrón y a medida que te mueves a la derecha a través de las filas, cada elemento posterior tiene un protón y un electrón adicionales. Quizás te hayas preguntado, ¿por qué se observan tendencias periódicas a lo largo de las filas y a la baja de los grupos? O bien, ¿por qué las filas tienen diferentes números de elementos, dando a la mesa una forma única?
Estas preguntas pueden ser respondidas aprendiendo más sobre los electrones en los átomos. Si bien hemos discutido la disposición general de las partículas subatómicas en los átomos, poco hemos dicho sobre cómo los electrones ocupan el espacio alrededor del núcleo. ¿Se mueven alrededor del núcleo al azar, o existen en algún arreglo ordenado?
En 1913, el científico danés Niels Bohr sugirió que el electrón en un átomo de hidrógeno no podía tener ninguna energía aleatoria, teniendo solo ciertos valores fijos de energía que estaban indexados por el número n (ahora llamado número cuántico). Bohr sugirió que la energía del electrón en hidrógeno se cuantificó porque estaba en una órbita específica; al igual que los escalones de una escalera no tienen media o cuarta escalera o las teclas de un piano no tienen notas en el medio, no hay niveles de energía entre cada órbita. La figura\(\PageIndex{1}\) muestra un modelo del átomo de hidrógeno basado en las ideas de Bohr.
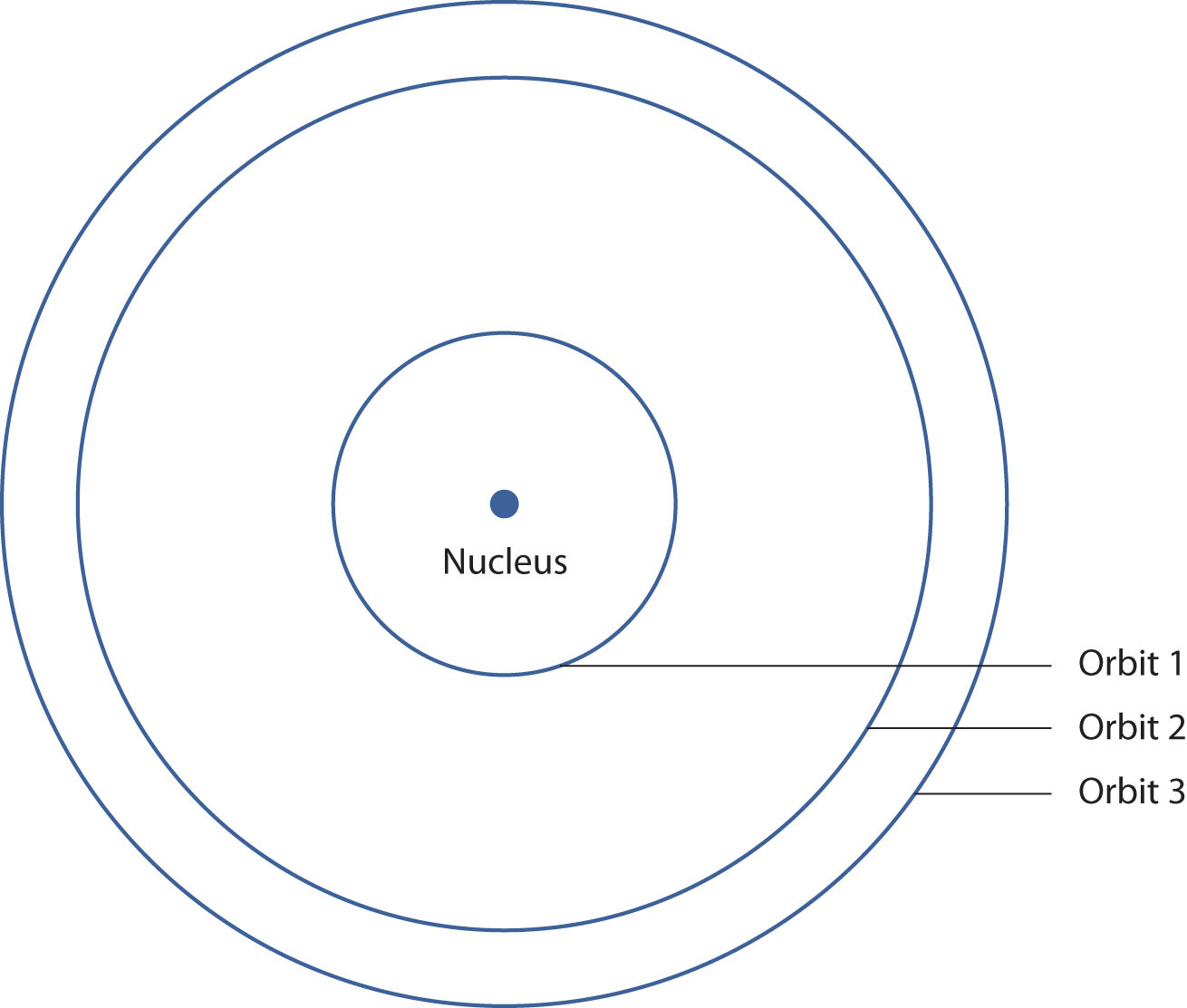
Las ideas de Bohr fueron útiles, pero solo eran aplicables al átomo de hidrógeno. Sin embargo, investigadores posteriores generalizaron las ideas de Bohr en una nueva teoría llamada mecánica cuántica, que explica el comportamiento de los electrones como si estuvieran actuando como una onda, no como partículas. La mecánica cuántica predice dos cosas principales: energías cuantificadas para electrones de todos los átomos (no solo hidrógeno) y una organización de electrones dentro de los átomos. Ya no se piensa que los electrones estén distribuidos aleatoriamente alrededor de un núcleo o restringidos a ciertas órbitas (en ese sentido, Bohr estaba equivocado). En cambio, los electrones se recogen en grupos (conchas) y subgrupos (subconchas) que explican mucho sobre el comportamiento químico del átomo.
En el modelo cuánto-mecánico de un átomo, que es el modelo moderno y actualmente aceptado, la ubicación de los electrones en el átomo se describe por cuatro números cuánticos, no solo el predicho por Bohr. Al igual que la dirección de tu casa se puede usar para ubicarte en un estado, ciudad, calle y número de casa específicos, los tres primeros números cuánticos identifican aproximadamente dónde están los electrones en un átomo. El cuarto número cuántico describe el electrón y si es spin up o down (en sentido horario o antihorario). La teoría y las matemáticas detrás de estos cuatro números cuánticos están mucho más allá del alcance de este libro de texto, sin embargo, es útil aprender algunos de los conceptos básicos para entender cómo se comportan los átomos e interactúan con (reaccionan) con otros átomos.
Arreglos de electrones: Conchas, Subconchas y Orbitales
Los electrones se organizan según sus energías en conjuntos llamados conchas (etiquetados por el número cuántico principal, n). Generalmente, cuanto mayor es la energía de un caparazón, más lejos está (en promedio) del núcleo. Las conchas no tienen distancias fijas específicas del núcleo, pero un electrón en una concha de mayor energía pasará más tiempo más lejos del núcleo que un electrón en una concha de menor energía.
Las conchas se dividen además en subconjuntos de electrones llamados subconchas, etiquetados por tipo como s, p, d o f. El primer caparazón tiene solo un subshell, s. El segundo caparazón tiene dos subconchas, s y p; el tercer caparazón tiene tres subconchas, s, p y d, y el cuarto caparazón tiene cuatro subconchas, s, p, d y f. Dentro de cada subcapa, los electrones están dispuestos en diferentes números de orbitales, una subcapa s está compuesta por una s orbital, una subcapa p tiene dos orbitales p, una subcapa d, cinco orbitales d y una f subshell, siete f orbitales. Cada orbital tiene una forma y orientación diferentes alrededor del núcleo (Figura\(\PageIndex{1}\), sin embargo, en lugar de representar una órbita, como su nombre indica, los orbitales definen un límite para la región del espacio donde es más probable que se encuentre un electrón dado. Por último, un solo orbital puede contener hasta dos electrones cada uno con un giro diferente.
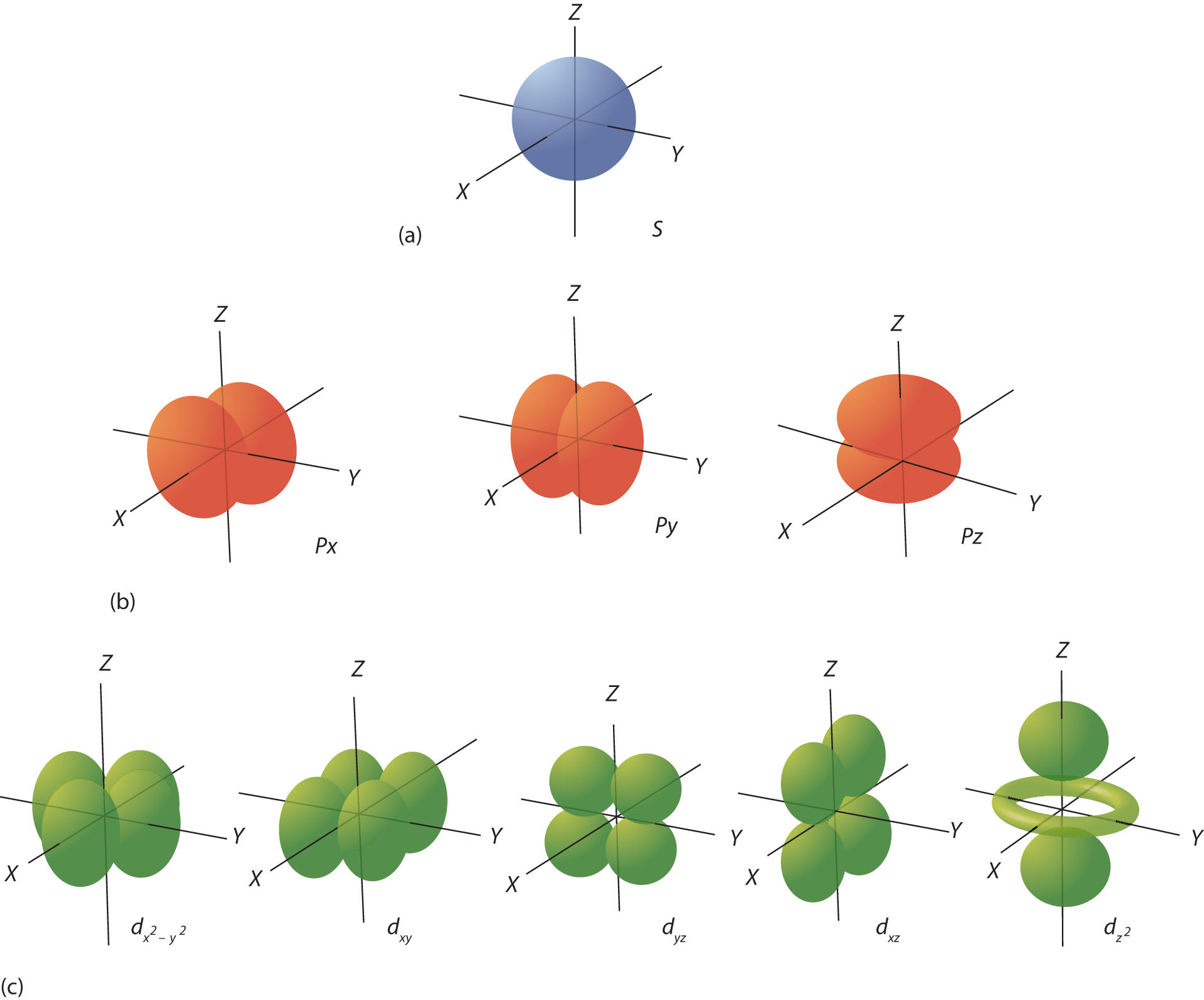
Es importante señalar que según la teoría cuántica, existen combinaciones permitidas específicas de números cuánticos y otras que no están permitidas. Por ejemplo, el caparazón dos solo puede tener dos subconchas, s con un orbital y p con 3 orbitales, por lo tanto, esta concha puede contener un máximo de ocho electrones (cuatro orbitales por dos electrones cada uno). Se necesita práctica para aprender las combinaciones permitidas como se muestra en la Tabla\ (\ PageIndex {1}\ pero es útil visualizar el átomo como una esfera con el núcleo en el centro. Cerca del núcleo, hay una menor cantidad de espacio para los electrones, una cáscara más pequeña. A medida que aumenta el número de electrones, las conchas que sostienen los electrones se hacen más grandes y así se alejan más del núcleo.
| Shell | Número de Subshells | Nombres de Subshells | Número de Orbitales (por Subshell) | Número de Electrones (por Subshell) | Electrones totales (por Shell) |
|---|---|---|---|---|---|
| 1 | 1 | 1s | 1 | 2 | 2 |
| 2 | 2 | 2s y 2p | 1, 3 | 2, 6 | 8 |
| 3 | 3 | 3s, 3p y 3d | 1, 3, 5 | 2, 6, 10 | 18 |
| 4 | 4 | 4s, 4p, 4d y 4f | 1, 3, 5, 7 | 2, 6, 10, 14 | 32 |
Toda esta información sobre el caparazón, la subcapa y el orbital se articula para conformar la “dirección” de un electrón y todas las direcciones de todos los electrones en un átomo conforman la configuración electrónica, que se describe más adelante.

