2.7: Configuraciones de electrones
- Page ID
- 73336
Objetivos de aprendizaje
- Describir cómo se disponen los electrones en un átomo usando configuraciones de electrones.
Anteriormente discutimos el concepto de conchas de electrones, subconchas, orbitales y espín de electrones. Es la disposición de los electrones en conchas y subconchas lo que más nos preocupa aquí, así que nos centraremos en eso.
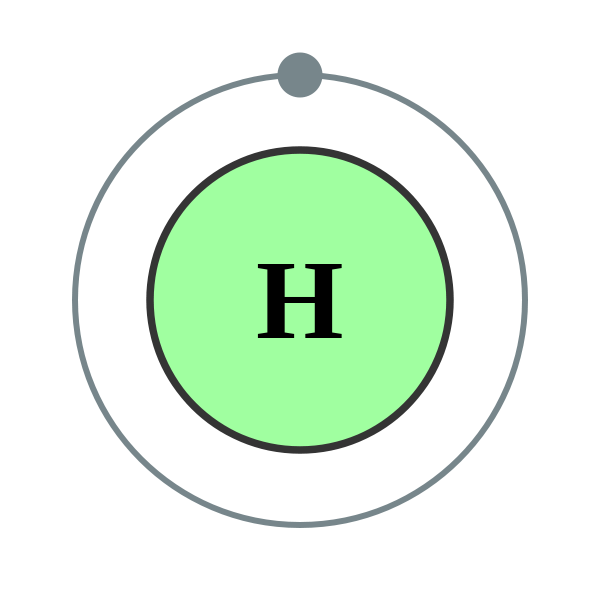
Usamos números para indicar en qué caparazón se encuentra un electrón. El primer caparazón, más cercano al núcleo y con los electrones de menor energía, es el caparazón 1. Este primer caparazón tiene solo una subcapa, la cual está etiquetada con 1 s y puede contener un máximo de 2 electrones. Combinamos las etiquetas shell y subshell cuando nos referimos a la organización de electrones alrededor de un núcleo y usamos un superíndice para indicar cuántos electrones hay en una subcapa. Así, debido a que un átomo de hidrógeno tiene su electrón único en la subcapa s de la primera capa, usamos 1 s 1 (hablado como “uno-eso-uno”) para describir la disposición o distribución de electrones en hidrógeno. Esta estructura se llama configuración electrónica y es exclusiva del hidrógeno.
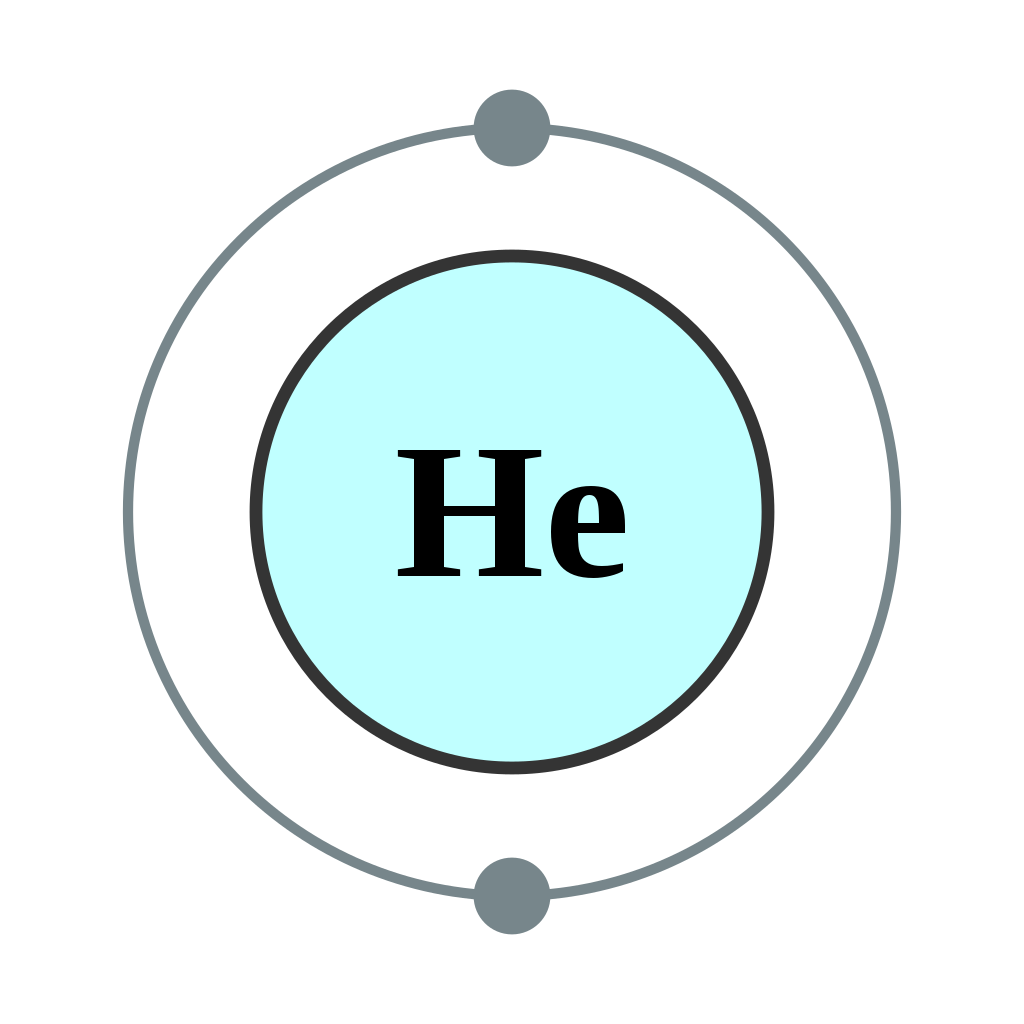
Los átomos de helio tienen 2 electrones. Ambos electrones encajan en la subcapa de 1 s porque las subcapas s contienen una s orbital que puede contener hasta 2 electrones; por lo tanto, la configuración de electrones para los átomos de helio es de 1 s 2 (hablada como “uno-es-dos”).
La subcapa de 1 s puede contener un máximo de 2 electrones, por lo que la configuración de electrones para un átomo de litio, que tiene tres electrones, no puede ser de 1 s 3. Dos de los electrones de litio pueden caber en la subcapa de 1 s, pero el tercer electrón debe entrar en la segunda capa y el orbital de menor energía, que es el orbital de 2 s. Por lo tanto, escribimos la configuración electrónica de un átomo de litio como 1 s 2 2 s 1 (hablado como “uno-es-dos dos-uno”).
El diagrama de cáscara para un átomo de litio (Figura\(\PageIndex{1}\)). La cáscara más cercana al núcleo (primera capa) tiene 2 puntos que representan los 2 electrones en 1 s, mientras que la capa más externa (2 s) tiene 1 electrón.

Hay un conjunto de reglas generales que se utilizan para determinar la configuración electrónica de una especie atómica: Principio de Aufbau, Regla de Hund y Principio de Pauli-Exclusión.
- Regla 1 (Principio Aufbau): Los electrones ocupan los orbitales de menor energía (más cercanos al núcleo) posibles, comenzando con 1 s, luego 2 s, 2 p, y continuando a energía superior (más lejos del núcleo). Los proyectiles aumentan de energía en orden de 1 a 2 a 3, y así sucesivamente. Dentro de estas conchas, una subcapa s es la energía más baja seguida de p, luego d, luego f.
- Regla 2 (Regla de Hund): Cuando los electrones ocupan orbitales degenerados (es decir, la misma concha y subcapa), primero deben ocupar individualmente (medio llenar) cada orbital vacío en una subcapa antes de ocuparlos dobles (llenarlos completamente). Además, la configuración más estable resulta cuando los giros son paralelos (es decir, todos los giros hacia arriba o todos los giros hacia abajo). Por ejemplo, los tres orbitales p en una subcapa p tendrán un electrón antes de que un solo orbital p contenga dos electrones.
- Regla 3 (Principio de Pauli-Exclusión): Cada electrón se describe con un conjunto único de cuatro números cuánticos (una dirección única). Por lo tanto, si dos electrones ocupan el mismo orbital, deben tener diferentes espines. Esta es la razón por la que todos los orbitales pueden contener un máximo de dos electrones.
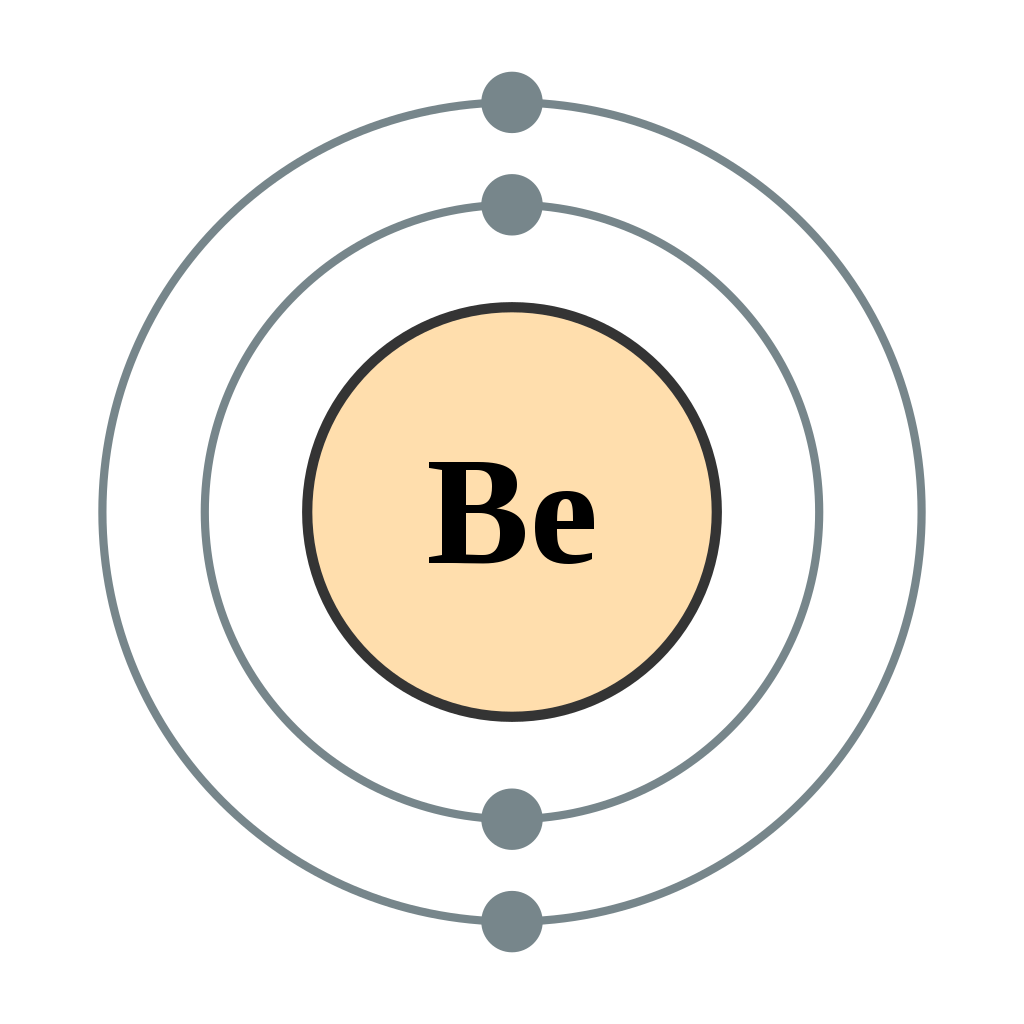
Continuando en la tabla periódica hasta el siguiente átomo más grande, el berilio, con 4 electrones, la configuración electrónica es de 1 s 2 2 s 2. Ahora que la subcapa de 2 s está llena, los electrones en átomos más grandes, comenzando con boro, comienzan a llenar la subcapa de 2 p, que puede contener un máximo de seis electrones. Los siguientes seis elementos llenan progresivamente el subshell 2p:
- B: 1s 2 2s 2 2p 1
- C: 1s 2 2s 2 2p 2
- N: 1s 2 2s 2 2p 3
- O: 1s 2 2s 2 2p 4
- F: 1s 2 2s 2 2p 5
- Ne: 1s 2 2s 2 2p 6
Al final del periodo el elemento neon, ha llenado las subconchas de 2 s, y 2 p, lo que completa el segundo caparazón. Ahora los átomos con más electrones ahora deben comenzar el tercer caparazón comenzando con la subcapa de 3 s. Las dos primeras subcubiertas de la tercera capa se rellenan en orden, por ejemplo, la configuración electrónica del aluminio, con 13 electrones, es 1 s 2 2 s 2 2 p 6 3 s 2 3 p 1. Sin embargo, ocurre algo curioso después de que se llena el subshell de 3 p: el subshell de 4 s comienza a llenarse antes de que lo haga el subshell de 3 d. De hecho, el orden exacto de las subconchas se vuelve más complicado en este punto (después del argón, con sus 18 electrones), por lo que no consideraremos las configuraciones de electrones de átomos más grandes.
| Número atómico | Símbolo de elemento | Concha más externa | Configuración de electrones | Configuración de gas noble |
|---|---|---|---|---|
| 1 | H | 1 | 1 s 1 | 1 s 1 |
| 2 | Él | 1 | 1 s 2 | 1 s 2 |
| 3 | Li | 2 | 1 s 2 2 s 1 | [Él] 2 s 1 |
| 4 | Be | 2 | 1 s 2 2 s 2 | [Él] 2 s 2 |
| 5 | B | 2 | 1 s 2 2 s 2 2 p 1 | [Él] 2 s 2 2 p 1 |
| 6 | C | 2 | 1 s 2 2 s 2 2 p 2 | [Él] 2 s 2 2 p 2 |
| 7 | N | 2 | 1 s 2 2 s 2 2 p 3 | [Él] 2 s 2 2 p 3 |
| 8 | O | 2 | 1 s 2 2 s 2 2 p 4 | [Él] 2 s 2 2 p 4 |
| 9 | F | 2 | 1 s 2 2 s 2 2 p 5 | [Él] 2 s 2 2 p 5 |
| 10 | Ne | 2 | 1 s 2 2 s 2 2 p 6 | [Él] 2 s 2 2 p 6 |
| 11 | Na | 3 | 1 s 2 2 s 2 p 6 3 s 1 | [Ne] 3 s 1 |
| 12 | Mg | 3 | 1 s 2 2 s 2 p 6 3 s 2 | [Ne] 3 s 2 |
| 13 | Al | 3 | 1 s 2 2 s 2 p 6 3 s 2 3 p 1 | [Ne] 3 s 2 3 p 1 |
| 14 | Si | 3 | 1 s 2 2 s 2 p 6 3 s 2 3 p 2 | [Ne] 3 s 2 3 p 2 |
| 15 | P | 3 | 1 s 2 2 s 2 p 6 3 s 2 3 p 3 | [Ne] 3 s 2 3 p 3 |
| 16 | S | 3 | 1 s 2 2 s 2 p 6 3 s 2 3 p 4 | [Ne] 3 s 2 3 p 4 |
| 17 | Cl | 3 | 1 s 2 2 s 2 p 6 3 s 2 3 p 5 | [Ne] 3 s 2 3 p 5 |
| 18 | Ar | 3 | 1 s 2 2 s 2 p 6 3 s 2 3 p 6 | [Ne] 3 s 2 3 p 6 |
| 19 | K | 4 | 1 s 2 2 s 2 p 6 3 s 2 3 p 6 4 s 1 | [Ar] 4 s 1 |
| 20 | Ca | 4 | 1 s 2 2 s 2 p 6 3 s 2 3 p 6 4 s 2 | [Ar] 4 s 2 |
Configuración de gas noble
La configuración electrónica del sodio es\(1s^2 2s^2 2p^6 3s^1\) (Tabla\(\PageIndex{1}\)). Los primeros diez electrones del átomo de sodio son los electrones de capa interna y la configuración de solo esos diez electrones es exactamente la misma que la configuración del elemento neón\(\left( Z=10 \right)\). Esto proporciona la base para una notación taquigráfica para configuraciones de electrones llamada configuración de gas noble, cuyo átomo consiste en el símbolo elemental del último gas noble anterior a ese átomo, seguido de la configuración de los electrones restantes. Entonces para el sodio, hacemos la sustitución de\(\left[ \ce{Ne} \right]\) por la\(1s^2 2s^2 2p^6\) parte de la configuración. La configuración del gas noble del sodio se vuelve\(\left[ \ce{Ne} \right] 3s^1\).
El diagrama de llenado de electrones que se muestra a continuación en la Figura\(\PageIndex{2}\) es útil para recordar el orden en que los electrones ocupan conchas y subcáscaras. Aunque es mucho más fácil usar la tabla periódica como guía para el llenado de electrones como verás en la siguiente sección.
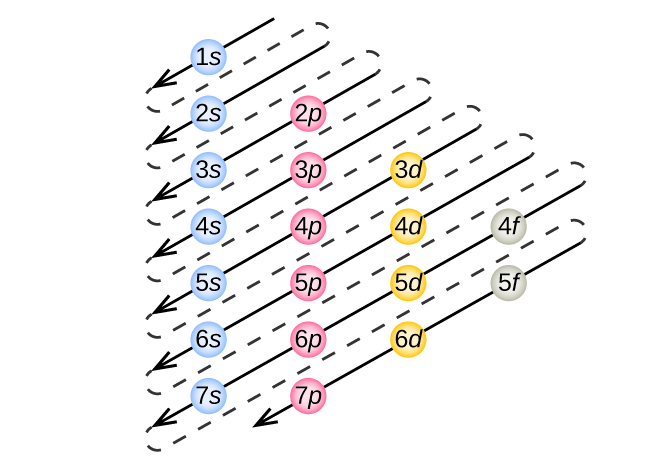
Ejemplo\(\PageIndex{1}\): Configuración electrónica de átomos de fósforo
Usando Figura\(\PageIndex{2}\) como guía, escriba la configuración electrónica de un átomo de fósforo neutro. El número atómico de P es 15.
Solución
Un átomo de fósforo neutro tiene 15 electrones. Dos electrones pueden entrar en la subcapa de 1 s, 2 pueden entrar en la subcapa de 2 s y 6 pueden entrar en la subcapa de 2 p. Eso deja 5 electrones. De esos 5 electrones, 2 pueden entrar en la subcapa de 3 s, y los 3 electrones restantes pueden entrar en la subcapa de 3 p. Así, la configuración electrónica de los átomos neutros de fósforo es 1 s 2 2 s 2 2 p 6 3 s 2 3 s 2 3 p 3.
Ejercicio\(\PageIndex{1}\): Configuración electrónica de átomos de cloro
Usando Figura\(\PageIndex{2}\) como guía, escriba la configuración electrónica de un átomo de cloro neutro. El número atómico de Cl es 17.
- Contestar
-
Un átomo de cloro neutro tiene 17 electrones. Dos electrones pueden entrar en la subcapa de 1 s, 2 pueden entrar en la subcapa de 2 s y 6 pueden entrar en la subcapa de 2 p. Eso deja 7 electrones. De esos 7 electrones, 2 pueden entrar en la subcapa de 3 s, y los 5 electrones restantes pueden entrar en la subcapa de 3 p. Así, la configuración electrónica de los átomos neutros de cloro es de 1 s 2 2 s 2 2 p 6 3 s 2 3 p 5.
Diagramas orbitales
Un diagrama orbital es la forma más visual de representar la disposición de todos los electrones en un átomo en particular. En un diagrama orbital, los orbitales individuales se muestran como cuadrados y los orbitales dentro de un subnivel se dibujan uno al lado del otro horizontalmente. Cada subnivel está etiquetado por su shell y subnivel. Los electrones se indican mediante flechas dentro de los cuadrados. Una flecha que apunta hacia arriba indica una dirección de giro, mientras que una flecha hacia abajo indica la otra dirección. Los diagramas de llenado orbital para hidrógeno, helio y litio se muestran en la siguiente figura.
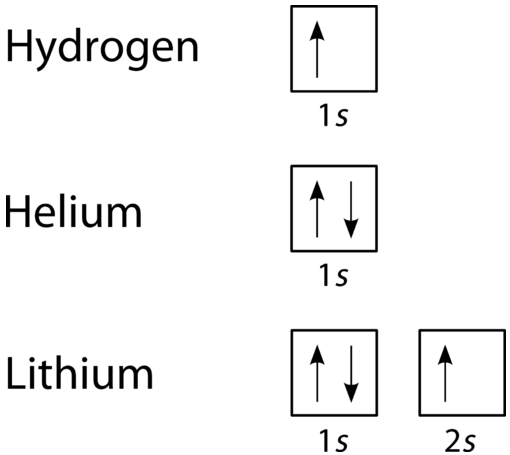
Según el Principio Aufbau, los subniveles y orbitales se llenan de electrones en orden de aumentar la energía. Dado que el\(s\) subnivel consiste en un solo orbital, el segundo electrón simplemente se empareja con el primer electrón como en helio. El siguiente elemento es el litio y requiere el uso del siguiente subnivel disponible, el\(2s\).
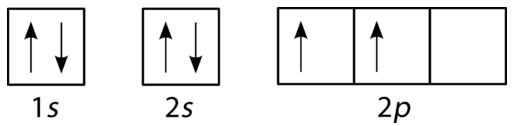
El diagrama orbital para el carbono se muestra en la Figura\(\PageIndex{10}\). Hay dos\(2p\) electrones para el carbono y cada uno ocupa su propio\(2p\) orbital (Regla de Hund).
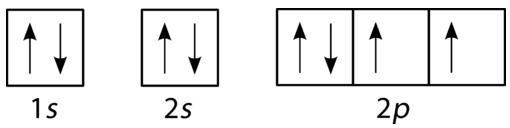
El oxígeno tiene cuatro\(2p\) electrones. Después de que cada\(2p\) orbital tenga un electrón en él, el cuarto electrón se puede colocar en el primer\(2p\) orbital con un espín opuesto al del otro electrón en ese orbital.
Si mantienes tus papeles en carpetas manila, puedes recoger una carpeta y ver cuánto pesa. Si quieres saber cuántos papeles diferentes (artículos, registros bancarios, o cualquier otra cosa que guardes en una carpeta), tienes que sacarlo todo y contar. Un directorio informático, por otro lado, te dice exactamente cuánto tienes en cada archivo. Podemos obtener la misma información sobre los átomos. Si usamos un diagrama de llenado orbital, tenemos que contar las flechas. Cuando miramos los datos de configuración de electrones, simplemente sumamos los números.
Dibuja el diagrama de llenado orbital para carbono y escribe su configuración electrónica.
Solución
Paso 1: Enumere las cantidades conocidas y planifique el problema.
Conocido
- Número atómico de carbono, Z=6
Utilice el diagrama de orden de llenado para dibujar un diagrama de llenado orbital con un total de seis electrones. Sigue la regla de Hund. Escribe la configuración electrónica.
Paso 2: Construye el diagrama.
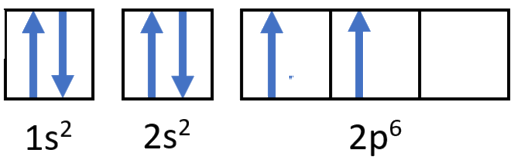
Diagrama de llenado orbital para carbono.
Configuración electrónica 1s 2 2s 2 2p 2
Paso 3: Piensa en tu resultado.
Siguiendo el subnivel 2s está el 2p, y los subniveles p siempre constan de tres orbitales. Los tres orbitales necesitan ser dibujados aunque uno o más estén desocupados. Según la regla de Hund, el sexto electrón entra en el segundo de esos p orbitales y tiene el mismo espín que el quinto electrón.

