3.6: Iones poliatómicos
- Page ID
- 72883
Objetivos de aprendizaje
- Identificar y nombrar iones poliatómicos.
Algunos iones consisten en grupos de átomos unidos covalentemente entre sí y tienen una carga eléctrica general. Debido a que estos iones contienen más de un átomo, se les llama iones poliatómicos. Las estructuras, nombres y fórmulas de algunos iones poliatómicos se encuentran en la siguiente figura y tabla.
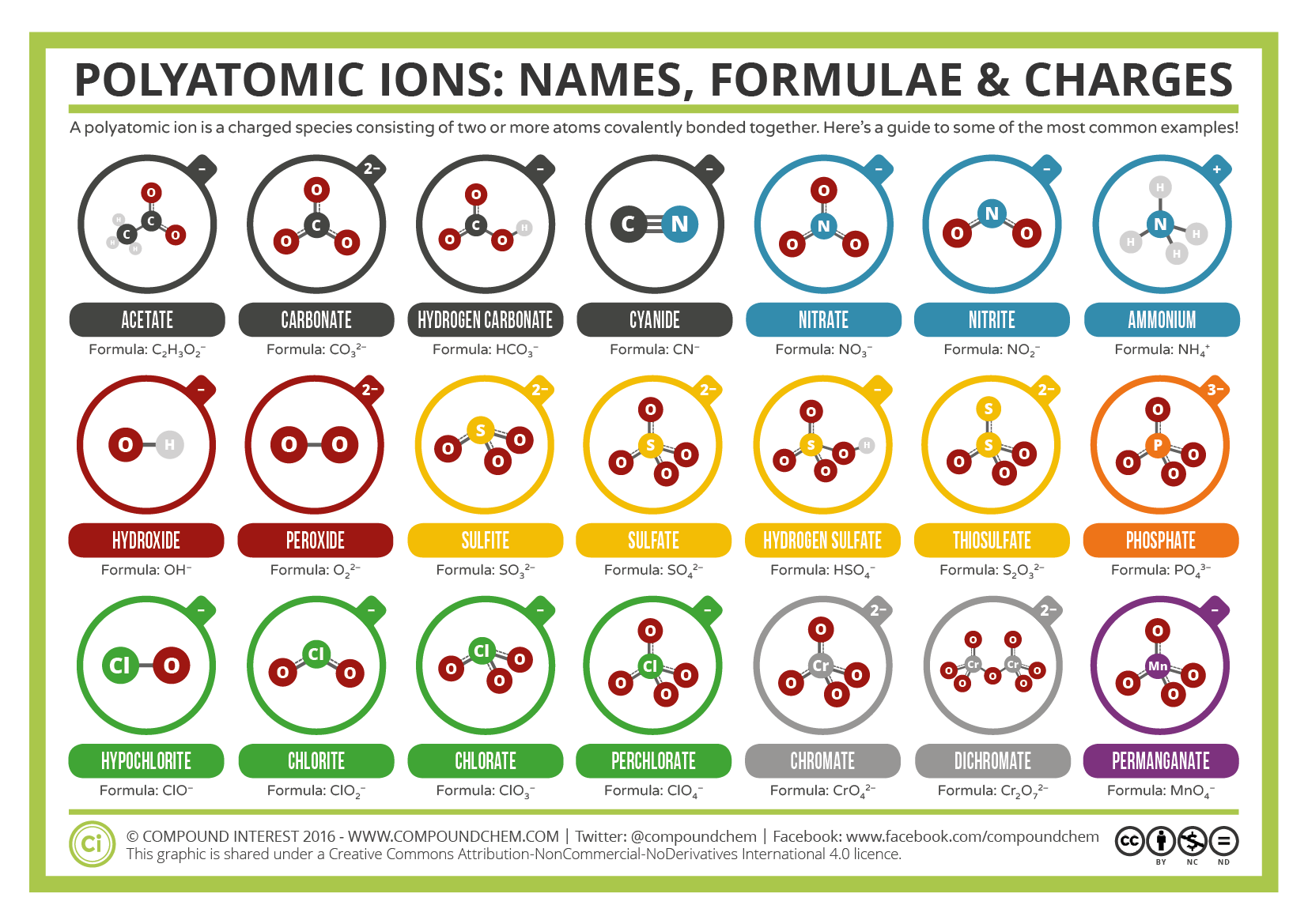
Los iones poliatómicos tienen fórmulas definidas, nombres y cargas que no se pueden modificar de ninguna manera. En la tabla se\(\PageIndex{1}\) enumeran los nombres de iones y fórmulas de iones de los iones poliatómicos más comunes. Por ejemplo,\(\ce{NO_3^{−}}\) es el ion nitrato; tiene un átomo de nitrógeno y tres átomos de oxígeno y una carga global −1.
| Nombre Ion | Fórmula Ion |
|---|---|
| ion hyddronium | H 3 O + |
| ión amonio | NH 4 + |
| ión hidróxido | OH − |
| ion cianuro | CN − |
| ion carbonato | CO 3 2 − |
| bicarbonato o hidrogenocarbonato | HCO 3 − |
| ion acetato | C 2 H 3 O 2 − o CH 3 CO 2 − |
| ion nitr ato | NO 3 − |
| ion nitr ite | NO 2 − |
| ion sulf ate | SO 4 2 − |
| ion sulf ite | SO 3 2 − |
| ion fosph ato | PO 4 3 − |
| ion fosfito | PO 3 3 − |
Obsérvese que solo dos iones poliatómicos en esta tabla son cationes, ion hidronio (H 3 O +) e ion amonio (NH 4 +), los iones poliatómicos restantes están todos cargados negativamente y, por lo tanto, se clasifican como aniones. Sin embargo, solo dos de estos, el ion hidróxido y el ion cianuro, se nombran usando el sufijo “- ide" que es típicamente indicativo de iones cargados negativamente. Los aniones poliatómicos restantes, que todos contienen oxígeno, en combinación con otro no metálico, existen como parte de una serie en la que el número de oxígenos dentro de la unidad poliatómica puede variar. Un solo sufijo, “-ide”, es insuficiente para distinguir los nombres de los aniones en una serie poliatómica relacionada. Por lo tanto, se emplean los sufijos "- ate" y "- ite", para denotar que los iones poliatómicos correspondientes forman parte de una serie. Adicionalmente, estos sufijos también indican el número relativo de oxígenos que están contenidos dentro de los iones poliatómicos. Tenga en cuenta que todos los iones poliatómicos cuyos nombres terminan en "-ate" contienen uno más oxígeno que aquellos aniones poliatómicos cuyos nombres terminan en "-ite”.” Desafortunadamente, al igual que el sistema común para nombrar metales de transición, estos sufijos solo indican el número relativo de oxígenos que están contenidos dentro de los iones poliatómicos. Por ejemplo, tanto el ion nitrato, simbolizado como NO 3 −, como el ion sulfato, simbolizado como SO 4 2 −, comparten un sufijo "-ate"”, sin embargo, el primero contiene tres oxígenos, y el segundo contiene cuatro. Adicionalmente, tanto el ion nitr ato como el ion sulfito contienen tres oxígenos, pero estos iones poliatómicos no comparten un sufijo común. Desafortunadamente, la naturaleza relativa de estos sufijos exige que las combinaciones de fórmula iónica/nombre de iones de los iones poliatómicos simplemente deben ser memorizadas.

