3.7: Enlaces iónicos
- Page ID
- 72864
Objetivos de aprendizaje
- Definir un enlace iónico, un compuesto iónico y una fuerza electrostática
- Reconocer la complejidad de las interacciones tridimensionales de enlace iónico involucradas en compuestos iónicos
Las partículas con carga de oposición se atraen entre sí. Esta fuerza de atracción a menudo se conoce como una atracción electrostática. Un enlace iónico es la atracción electrostática electrostática que mantiene los iones juntos en un compuesto iónico. La fuerza del enlace iónico depende directamente de la cantidad de cargas e inversamente depende de la distancia entre las partículas cargadas. Un catión con una carga 2+ hará un enlace iónico más fuerte que un catión con una carga 1+. Un ion más grande hace un enlace iónico más débil debido a la mayor distancia entre sus electrones y el núcleo del ion cargado opositivamente.
Utilizaremos cloruro de sodio como ejemplo para demostrar la naturaleza del enlace iónico y cómo se forma. Como saben, el sodio es un metal y pierde su único electrón de valencia para convertirse en catión. El cloro es un no metal y gana un electrón al convertirse en un anión. Sin embargo, los electrones no pueden simplemente “perderse” a ninguna parte en particular. Una forma más precisa de describir lo que está sucediendo es que un solo electrón se transfiere del átomo de sodio al átomo de cloro como se muestra a continuación.
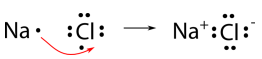
El enlace iónico es la atracción del\(\ce{Na^{+}}\) ion por el\(\ce{Cl^{-}}\) ion. Es convencional mostrar el catión sin puntos alrededor del símbolo para enfatizar que el nivel de energía original que contenía el electrón de valencia ahora está vacío. El anión se muestra ahora con un octeto completo de electrones.
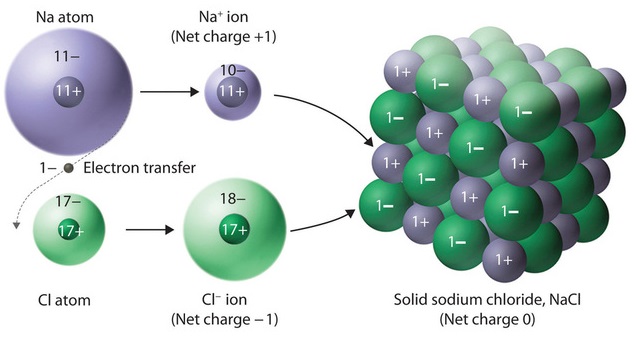
Los compuestos iónicos se mantienen unidos por interacciones electrostáticas atractivas entre cationes y aniones. En contraste con la transferencia electrónica simplificada representada anteriormente para sodio y cloro, los cationes y aniones en los compuestos iónicos están dispuestos en el espacio para formar una matriz tridimensional extendida que maximiza el número de interacciones electrostáticas atractivas y minimiza el número de electrostática repulsiva interacciones (Figura\(\PageIndex{1}\)). En otras palabras, cada ion es atraído por muchos de sus iones vecinos formando un cristal de cloruro de sodio o un sólido iónico.
Colaboradores y Atribuciones
CK-12 Foundation by Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson, and Jean Dupon.

