3.8: Fórmulas de Compuestos Iónicos
- Page ID
- 72893
Objetivos de aprendizaje
- Escriba la fórmula química para un compuesto iónico simple basado en las cargas de los cationes y aniones en el compuesto.
En cada compuesto iónico, el número total de cargas positivas de los cationes es igual al número total de cargas negativas de los aniones. Así, los compuestos iónicos son eléctricamente neutros en general, a pesar de que contienen iones positivos y negativos. Podemos usar esta observación para ayudarnos a escribir la fórmula de un compuesto iónico. La fórmula de un compuesto iónico debe tener una relación de iones tal que los números de cargas positivas y negativas sean iguales.
Compuestos iónicos formados a partir de iones monoatómicos
Considera un átomo de Na en presencia de un átomo de Cl. Los dos átomos tienen estos diagramas de puntos electrónicos de Lewis y configuraciones de electrones:
\[\mathbf{Na\, \cdot }\; \; \; \; \; \; \; \; \; \; \mathbf{\cdot }\mathbf{\ddot{\underset{.\: .}Cl}}\mathbf{\: :}\nonumber \]
\[\left [ Ne \right ]3s^{1}\; \; \; \; \left [ Ne \right ]3s^{2}3p^{5}\nonumber \]
Para que el átomo de Na obtenga un octeto, debe perder un electrón; para que el átomo de Cl obtenga un octeto, debe ganar un electrón. Un electrón se transfiere del átomo de Na al átomo de Cl:
\[\mathbf{Na\, \cdot }\curvearrowright \mathbf{\cdot }\mathbf{\ddot{\underset{.\: .}Cl}}\mathbf{\: :}\nonumber \]
dando como resultado dos iones, el ion Na + y el ion Cl −:
\[\mathbf{Na\, \cdot }^{+}\; \; \; \; \; \; \; \; \mathbf{:}\mathbf{\ddot{\underset{.\: .}Cl}}\mathbf{\: :}^{-}\nonumber \]
\[\left [ Ne \right ]\; \; \; \; \; \left [ Ne \right ]3s^{2}3p^{6}\nonumber \]
Ambas especies ahora tienen octetos completos, y las conchas de electrones son energéticamente estables. A partir de la física básica, sabemos que las cargas opuestas atraen. Esto es lo que sucede con los iones Na + y Cl −:
\[\mathbf{Na\, \cdot }^{+}\; + \; \mathbf{:}\mathbf{\ddot{\underset{.\: .}Cl}}\mathbf{\: :}^{-}\rightarrow Na^{+}Cl^{-}\; \; or\; \; NaCl\nonumber \]
donde hemos escrito la fórmula final (la fórmula para el cloruro de sodio) según la convención para compuestos iónicos, sin enumerar explícitamente las cargas. Como se explicó anteriormente, la atracción entre iones con carga contraria se denomina enlace iónico.
En la transferencia de electrones, el número de electrones perdidos debe ser igual al número de electrones ganados. Esto lo vimos en la formación de NaCl. Un proceso similar ocurre entre los átomos de Mg y los átomos de O, excepto en este caso se transfieren dos electrones:
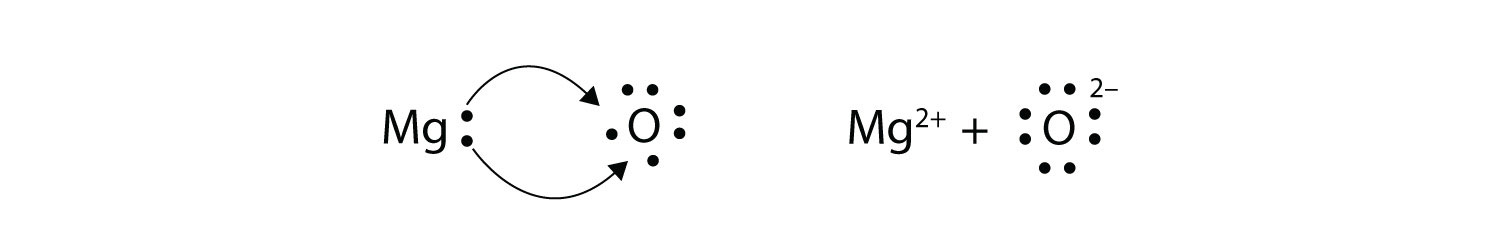
Cada uno de los dos iones tiene octetos como su capa de valencia, y las dos partículas con carga contraria se atraen, formando un enlace iónico:
\[\mathbf{Mg\,}^{2+}\; + \; \mathbf{:}\mathbf{\ddot{\underset{.\: .}O}}\mathbf{\: :}^{2-}\; \; \; \; \; Mg^{2+}O^{2-}\; or\; MgO\nonumber \]
¿Qué pasa cuando un átomo de Na interactúa con un átomo de O? El átomo de O necesita dos electrones para completar su octeto de valencia, pero el átomo de Na suministra solo un electrón:
\[\mathbf{Na\, \cdot }\curvearrowright \mathbf{\cdot }\mathbf{\ddot{\underset{.}O}}\mathbf{\: :}\nonumber \]
El átomo O todavía no tiene un octeto de electrones. Lo que necesitamos es un segundo átomo de Na para donar un segundo electrón al átomo de O:
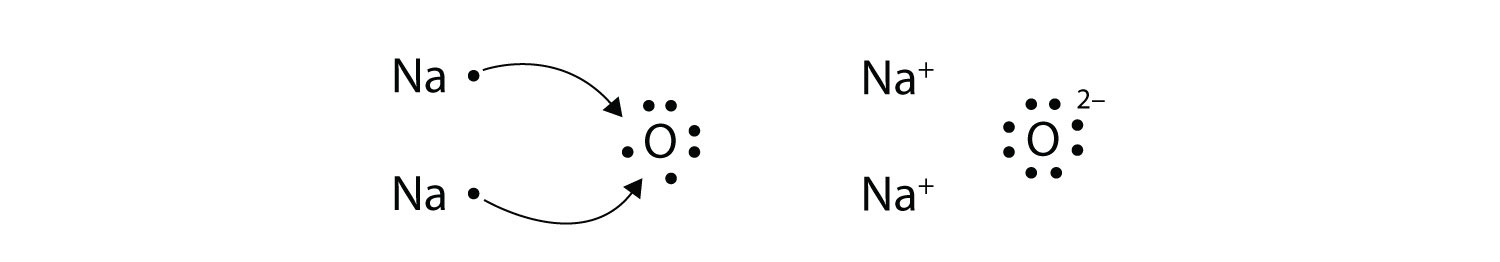
Estos tres iones se atraen entre sí para formar un compuesto iónico global cargado neutralmente, que escribimos como Na 2 O. La necesidad de que el número de electrones perdidos sea igual al número de electrones ganados explica por qué los compuestos iónicos tienen la relación de cationes a aniones que hacen. Esto también lo exige la ley de conservación de la materia.
Ejemplo\(\PageIndex{1}\)
Con flechas, ilustran la transferencia de electrones para formar cloruro de calcio a partir de átomos de Ca y átomos de Cl.
Solución
Un átomo de Ca tiene dos electrones de valencia, mientras que un átomo de Cl tiene siete electrones. Un átomo de Cl solo necesita uno más para completar su octeto, mientras que los átomos de Ca tienen dos electrones que perder. Necesitamos dos átomos de Cl para aceptar los dos electrones de un átomo de Ca. El proceso de transferencia es el siguiente:
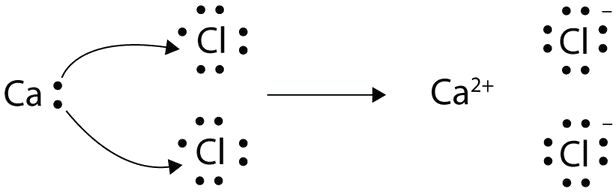
Los iones con carga contraria se atraen entre sí para hacer CaCl 2.
Ejercicio\(\PageIndex{1}\)
Con flechas, ilustran la transferencia de electrones para formar sulfuro de potasio a partir de átomos de K y átomos de S.
- Contestar
-
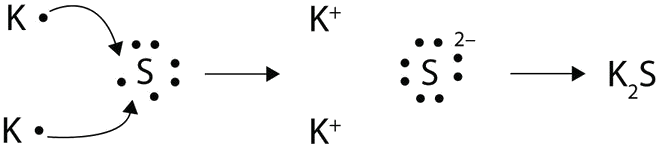
Dos átomos de potasio donan un electrón al azufre para llenar el orbital del azufre y vaciar el suyo propio, creando así dos K+ y uno S2-. Se enlazan iónicamente para formar K2S.
Para compuestos en los que la relación de iones no es tan obvia, los subíndices en la fórmula se pueden obtener cruzando cargas: usar el valor absoluto de la carga en un ion como subíndice para el otro ion. Este método se muestra esquemáticamente en la Figura 3.3.2.
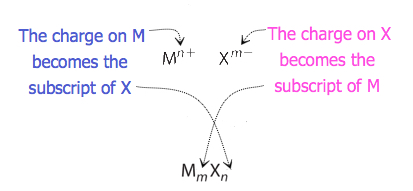
Al cruzar cargas, a veces es necesario reducir los subíndices a su relación más simple para escribir la fórmula empírica. Consideremos, por ejemplo, el compuesto formado por Pb 4 + y O 2−. El uso de los valores absolutos de las cargas en los iones como subíndices da la fórmula Pb 2 O 4. Esto simplifica a su correcta fórmula empírica PbO 2. La fórmula empírica tiene un ion Pb 4 + y dos iones O 2−.
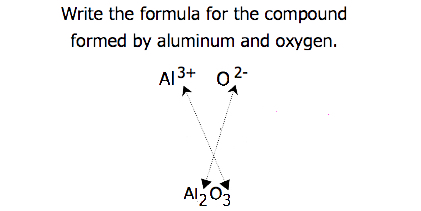
El zafiro de la piedra preciosa (Figura\(\PageIndex{2}\)) es principalmente un compuesto de aluminio y oxígeno que contiene cationes de aluminio, Al 3 +, y aniones de oxígeno, O 2−. ¿Cuál es la fórmula de este compuesto?

Solución
Debido a que el compuesto iónico debe ser eléctricamente neutro, debe tener el mismo número de cargas positivas y negativas. Dos iones de aluminio, cada uno con una carga de 3+, nos darían seis cargas positivas, y tres iones óxido, cada uno con una carga de 2−, nos darían seis cargas negativas. La fórmula sería Al 2 O 3.
Predecir la fórmula del compuesto iónico formado entre el catión sodio, Na +, y el anión sulfuro, S2-.
- Contestar
-
Na 2 S
Compuestos iónicos formados a partir de iones poliatómicos
Muchos compuestos iónicos contienen iones poliatómicos como el catión, el anión o ambos. Al igual que con los compuestos iónicos simples, estos compuestos también deben ser eléctricamente neutros, por lo que sus fórmulas pueden predecirse tratando los iones poliatómicos como unidades discretas. Usamos paréntesis en una fórmula para indicar un grupo de átomos que se comportan como una unidad. Por ejemplo, la fórmula para el fosfato de calcio, uno de los minerales en nuestros huesos, es Ca 3 (PO 4) 2. Esta fórmula indica que hay tres iones calcio (Ca 2 +) por cada dos\(\left(\ce{PO4^{3-}}\right)\) grupos fosfato. Los\(\ce{PO4^{3-}}\) grupos son unidades discretas, cada una compuesta por un átomo de fósforo y cuatro átomos de oxígeno, y con una carga global de 3−. El compuesto es eléctricamente neutro, y su fórmula muestra un recuento total de tres átomos de Ca, dos P y ocho átomos de O.
El polvo de hornear contiene dihidrogenofosfato de calcio, un compuesto iónico compuesto por los iones Ca 2 + y\(\ce{H2PO4-}\). ¿Cuál es la fórmula de este compuesto?
Solución
Las cargas positivas y negativas deben equilibrarse, y este compuesto iónico debe ser eléctricamente neutro. Así, debemos tener dos cargas negativas para equilibrar la carga 2+ del ion calcio. Esto requiere una relación de un ion Ca 2 + a dos\(\ce{H2PO4-}\) iones. Esto lo designamos encerrando la fórmula para el ion dihidrógeno fosfato entre paréntesis y agregando un subíndice 2. La fórmula es Ca (H 2 PO 4) 2.
Escriba la fórmula química para un compuesto iónico compuesto por cada par de iones.
- el ion magnesio y el ion carbonato
- el ion aluminio y el ion acetato
- Respuesta a:
-
Mg 2 + y CO 3 2 - = MgCO 3
- Respuesta b:
-
Al 3 + y C 2 H 3 O 2 - = Al (C 2 H 3 O 2) 3
Unidad de Fórmula
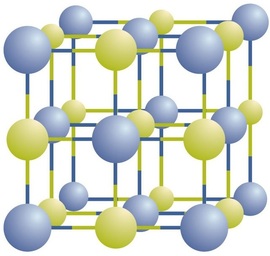
Los compuestos iónicos existen como iones positivos y negativos alternantes en matrices tridimensionales regulares llamadas cristales (Figura\(\PageIndex{3}\)). Como puede ver, no hay\(\ce{NaCl}\) “partículas” individuales en la matriz; en cambio, hay una red continua de iones de sodio y cloruro alternos. Sin embargo, podemos usar la relación de iones sodio a iones cloruro, expresada en los números enteros más bajos posibles o fórmula más simple, como una forma de describir el compuesto. En el caso del cloruro de sodio, la relación de iones sodio a iones cloruro, expresada en números enteros más bajos, es 1:1, por lo que usamos\(\ce{NaCl}\) (un\(\ce{Na}\) símbolo y un\(\ce{Cl}\) símbolo) para representar el compuesto. Así,\(\ce{NaCl}\) es la fórmula química para el cloruro de sodio, que es una forma concisa de describir el número relativo de diferentes iones en el compuesto. Una muestra macroscópica está compuesta por miríadas de pares de NaCl; cada par individual se denomina unidad de fórmula. Si bien es conveniente pensar que los\(\ce{NaCl}\) cristales están compuestos por\(\ce{NaCl}\) unidades individuales, la Figura\(\PageIndex{3}\) muestra que ningún ion único está asociado exclusivamente con ningún otro solo ion. Cada ion está rodeado por iones de carga opuesta.