4.1: Enlaces covalentes
- Page ID
- 72784
Objetivos de aprendizaje
- Describir cómo se forman los enlaces covalentes usando la regla del octeto.
En los compuestos iónicos, los electrones se transfieren entre átomos de diferentes elementos para formar iones. Pero esta no es la única forma en que se pueden formar compuestos. Los átomos también pueden hacer enlaces químicos al compartir electrones entre sí para completar su subcapa externa con ocho electrones de valencia, siguiendo la regla del octeto. Dichos enlaces se denominan enlaces covalentes y los átomos que se mantienen unidos por enlaces covalentes conforman lo que se llama una molécula.
Formación de enlaces covalentes
Los átomos no metálicos frecuentemente forman enlaces covalentes con otros átomos no metálicos. Los enlaces covalentes se forman entre dos átomos cuando ambos tienen tendencias similares a atraer electrones hacia ellos mismos (es decir, cuando ambos átomos tienen energías de ionización y afinidades electrónicas idénticas o bastante similares). Por ejemplo, dos átomos de hidrógeno se unen covalentemente para formar una molécula H 2; cada átomo de hidrógeno en la molécula H 2 tiene dos electrones estabilizándolo, dando a cada átomo el mismo número de electrones de valencia que el gas noble He.
El enlace en una molécula de hidrógeno, medido como la distancia entre los dos núcleos, es de aproximadamente 7.4 × 10 −11 m, o 74 picometros (pm; 1 pm = 1 × 10 −12 m). Esta longitud de enlace particular representa el estado de energía potencial más bajo de dos átomos de hidrógeno y es un equilibrio entre varias fuerzas: las atracciones entre electrones y núcleos cargados opositamente, la repulsión entre dos electrones cargados negativamente, y la repulsión entre dos núcleos cargados positivamente.
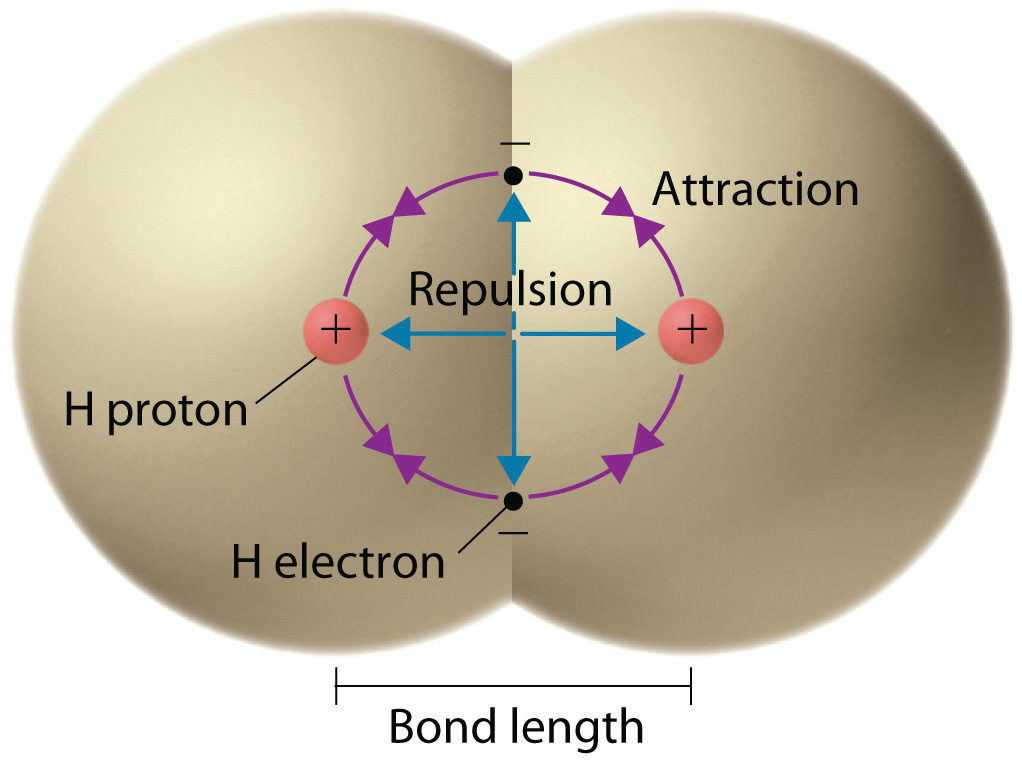
Una gráfica de la energía potencial del sistema en función de la distancia internuclear (Figura\(\PageIndex{2}\)) muestra que la energía disminuye a medida que dos átomos de hidrógeno se mueven uno hacia el otro. Comenzando por el extremo derecho, tenemos dos átomos de hidrógeno separados con una energía potencial particular, indicada por la línea roja. A lo largo del eje x se encuentra la distancia entre los dos átomos. A medida que los dos átomos se acercan entre sí (moviéndose a la izquierda a lo largo del eje x), sus orbitales de valencia (1 s) comienzan a superponerse. Los electrones individuales en cada átomo de hidrógeno interactúan entonces con ambos núcleos atómicos, ocupando el espacio alrededor de ambos átomos. La fuerte atracción de cada electrón compartido hacia ambos núcleos estabiliza el sistema, y la energía potencial disminuye a medida que disminuye la distancia del enlace. Si los átomos continúan acercándose entre sí, las cargas positivas en los dos núcleos comienzan a repelerse entre sí, y la energía potencial aumenta.
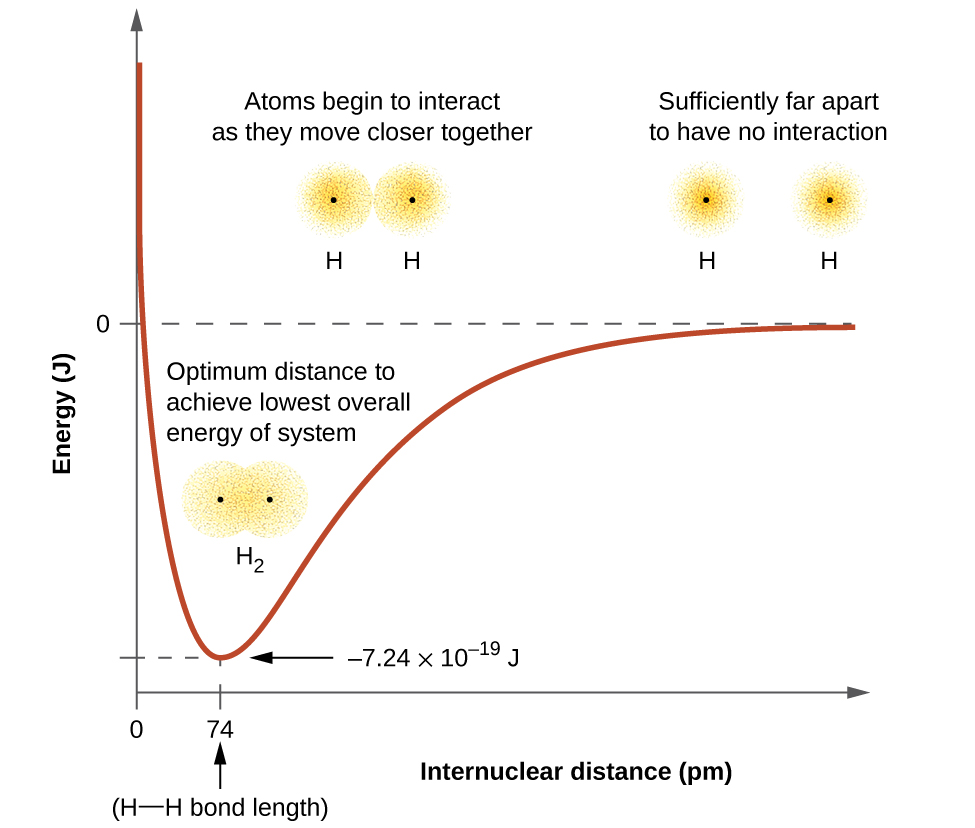
Figura\(\PageIndex{2}\): La interacción de dos átomos de hidrógeno cambia en función de la distancia. La energía del sistema cambia a medida que los átomos interactúan. La energía más baja (más estable) ocurre a una distancia de 74 pm, que es la longitud del enlace observada para la molécula H 2.
Estructuras de Lewis
Los químicos utilizan frecuentemente estructuras de Lewis para representar enlaces covalentes en sustancias moleculares. Por ejemplo, los símbolos de Lewis de dos átomos de hidrógeno separados son los siguientes:

Las estructuras de Lewis de dos átomos de hidrógeno que comparten electrones se ven así:

Podemos usar círculos para mostrar que cada átomo H tiene dos electrones alrededor del núcleo, llenando completamente la capa de valencia de cada átomo:
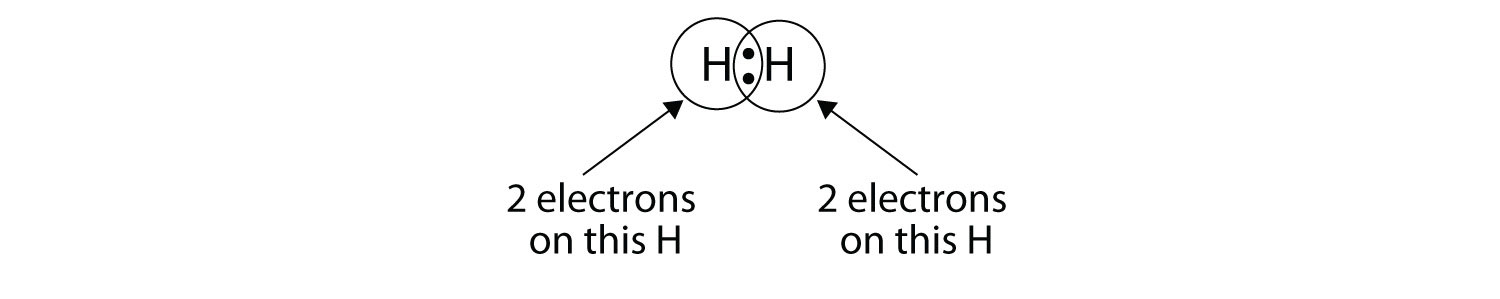
Debido a que cada átomo de H tiene una capa de valencia llena, este enlace es estable, y hemos hecho una molécula de hidrógeno diatómico. Por simplicidad, es común representar el enlace covalente con un guión, en lugar de con dos puntos:
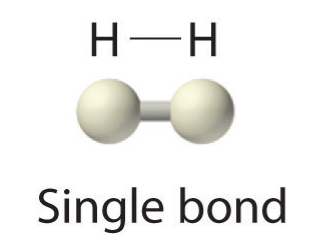
Debido a que dos átomos comparten un par de electrones, este enlace covalente se denomina enlace sencillo. Como otro ejemplo, considere el flúor. Los átomos F tienen siete electrones en su caparazón de valencia:
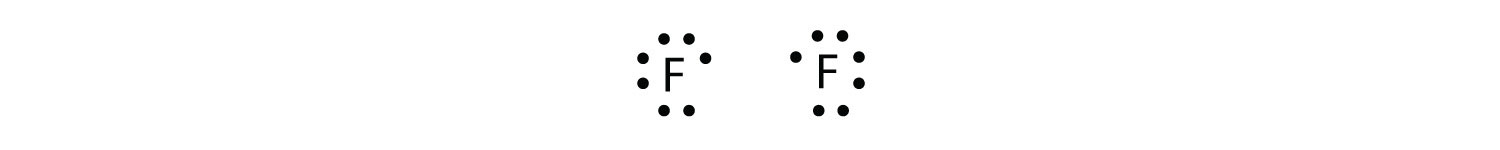
Estos dos átomos pueden hacer lo mismo que hicieron los átomos de H; comparten sus electrones desapareados para hacer un enlace covalente.

Tenga en cuenta que cada átomo F tiene un octeto completo a su alrededor ahora:
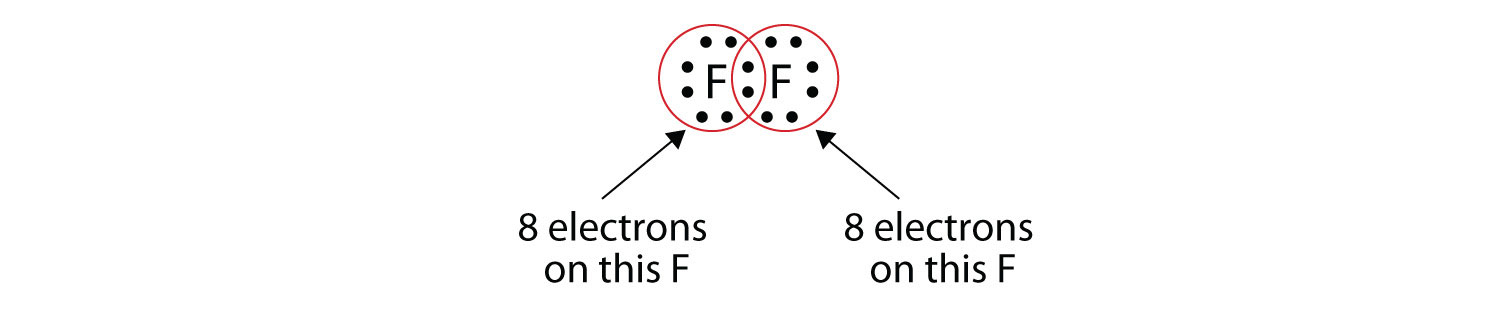
También podemos escribir esto usando un guión para representar el par de electrones compartido:
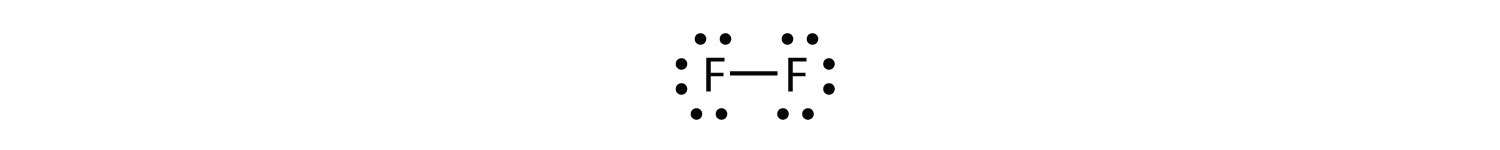
Notarás que hay dos tipos diferentes de electrones en la molécula diatómica de flúor. El par de electrones de enlace hace el enlace covalente. Cada átomo F tiene otros tres pares de electrones que no participan en el enlace; se les llama electrones de par solitario. Cada átomo F tiene un par de enlace y tres pares solitarios de electrones.
Moléculas Diatómicas
El hidrógeno (\(\ce{H2}\)) y el flúor (\(\ce{F2}\)) se describen como moléculas diatómicas. Estos elementos y otros (ver Tabla\(\PageIndex{1}\)) existen naturalmente como moléculas más que como átomos individuales. Es importante señalar que los nombres de estos elementos representan moléculas y no átomos individuales. Al describir un solo átomo en lugar de una molécula, se usa la palabra átomo.
| Hidrógeno (\(\ce{H2}\)) | Oxígeno (\(\ce{O2}\)) | Nitrógeno (\(\ce{N2}\)) | Flúor (\(\ce{F2}\)) |
|---|---|---|---|
| \ (\ ce {H2}\)) ">Cloro (\(\ce{Cl2}\)) | \ (\ ce {O2}\)) ">Bromo (\(\ce{Br2}\)) | \ (\ ce {N2}\)) ">Yodo (\(\ce{I2}\)) | \ (\ ce {F2}\)) "> |

