4.2: Los enlaces covalentes y la tabla periódica
- Page ID
- 72785
Objetivos de aprendizaje
- Predecir el número de enlaces covalentes formados en función de los elementos involucrados y su posición en la tabla periódica.
- Describir las excepciones importantes a la regla del octeto.
Las moléculas diatómicas como hidrógeno (\(\ce{H2}\)), cloro (\(\ce{Cl2}\)), flúor (\(\ce{F2}\)), etc. que contienen enlaces covalentes entre dos del mismo tipo de átomo son solo algunos ejemplos del gran número de moléculas que se pueden formar. Dos átomos diferentes también pueden compartir electrones y formar enlaces covalentes. Por ejemplo, el agua, (\(\ce{H2O}\)), tiene dos enlaces covalentes entre un solo átomo de oxígeno y dos átomos de hidrógeno. El amoníaco, (\(\ce{NH3}\), es un átomo de nitrógeno central unido a tres átomos de hidrógeno. El metano, (\(\ce{CH4}\), es un solo átomo de carbono unido covalentemente a cuatro átomos de hidrógeno. En estos ejemplos los átomos centrales forman diferentes números de enlaces a los átomos de hidrógeno para completar su subcapa de valencia y formar octetos.
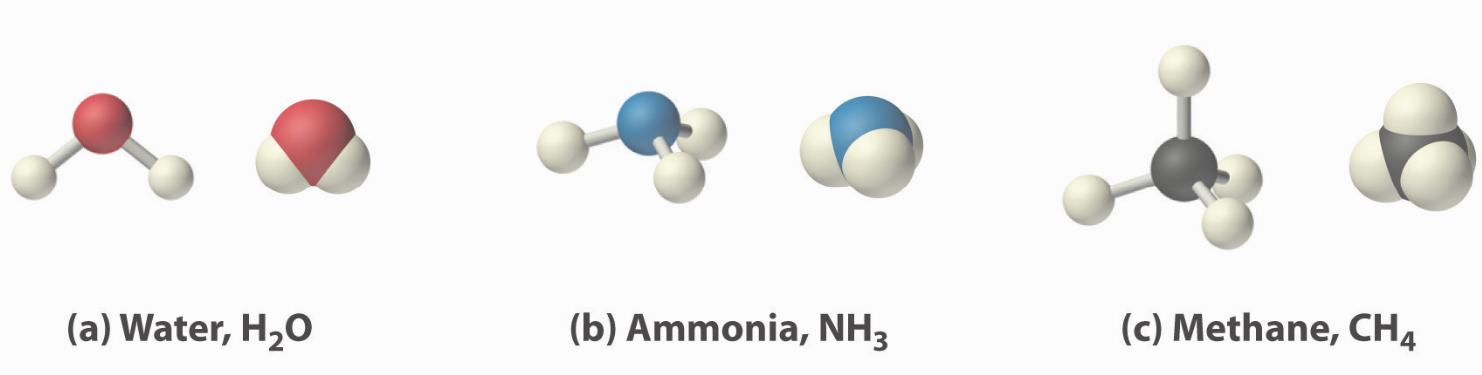
¿Cuántos enlaces covalentes se forman?
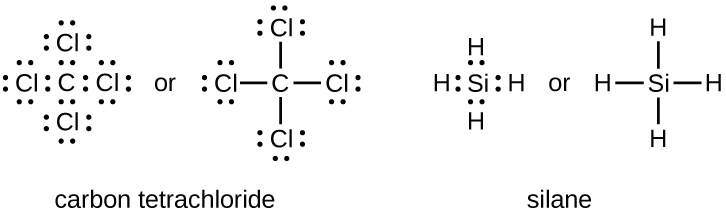
El número de enlaces que puede formar un átomo a menudo se puede predecir a partir del número de electrones necesarios para alcanzar un octeto (ocho electrones de valencia); esto es especialmente cierto para los no metales del segundo período de la tabla periódica (C, N, O y F). Por ejemplo, cada átomo de un elemento del grupo 14 tiene cuatro electrones en su caparazón más exterior y por lo tanto requiere cuatro electrones más para alcanzar un octeto. Estos cuatro electrones se pueden ganar formando cuatro enlaces covalentes, como se ilustra aquí para el carbono en CCl 4 (tetracloruro de carbono) y silicio en SiH 4 (silano). Debido a que el hidrógeno solo necesita dos electrones para llenar su caparazón de valencia, es una excepción a la regla del octeto y solo necesita formar un enlace. Los elementos de transición y los elementos de transición internos tampoco siguen la regla del octeto ya que tienen electrones d y f involucrados en sus conchas de valencia.
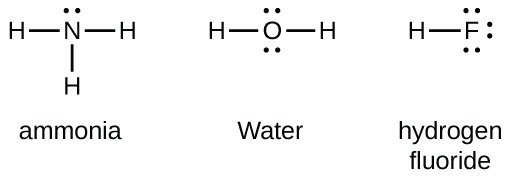
Los elementos del grupo 15 como el nitrógeno tienen cinco electrones de valencia en el símbolo atómico de Lewis: un par solitario y tres electrones desapareados. Para obtener un octeto, estos átomos forman tres enlaces covalentes, como en NH 3 (amoníaco). El oxígeno y otros átomos del grupo 16 obtienen un octeto formando dos enlaces covalentes:
El número de electrones requeridos para obtener un octeto determina el número de enlaces covalentes que puede formar un átomo. Esto se resume en la siguiente tabla. En cada caso, la suma del número de enlaces y el número de pares solitarios es de 4, lo que equivale a ocho electrones (octeto).
| Átomo (Número de grupo) | Número de bonos | Número de Pares Solitarios |
|---|---|---|
| Carbono (Grupo 14) | 4 | 0 |
| Nitrógeno (Grupo 15) | 3 | 1 |
| Oxígeno (Grupo 16) | 2 | 2 |
| Flúor (Grupo 17) | 1 | 3 |
Debido a que el hidrógeno solo necesita dos electrones para llenar su caparazón de valencia, sigue la regla del dueto. El hidrógeno solo necesita formar un enlace para completar un dúo de electrones. Esta es la razón por la que H es siempre un átomo terminal y nunca un átomo central.
Ejemplo\(\PageIndex{1}\)
Examine la estructura de Lewis de la DE 2 a continuación. Contar el número de enlaces formados por cada elemento. Con base en la ubicación del elemento en la tabla periódica, ¿corresponde al número esperado de bonos que se muestra en la Tabla 4.1? ¿La estructura de Lewis a continuación sigue la regla del octeto?
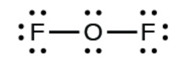
Solución
Sí. F (grupo 7A) forma un enlace y O (grupo 6A) forma 2 enlaces. Cada átomo está rodeado por 8 electrones. Esta estructura satisface la regla del octeto.
Ejercicio\(\PageIndex{1}\)
Examine la estructura de Lewis de NCl 3 a continuación. Contar el número de enlaces formados por cada elemento. Con base en la ubicación del elemento en la tabla periódica, ¿corresponde al número esperado de bonos que se muestra en la Tabla 4.1? ¿La estructura de Lewis a continuación sigue la regla del octeto?
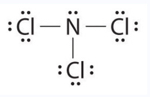
- Contestar
-
Tanto Cl como N forman el número esperado de bonos. Cl (grupo 7A) tiene un enlace y 3 pares solitarios. El átomo central N (grupo 5A) tiene 3 enlaces y un par solitario. Sí, la estructura Lewis de NCl 3 sigue la regla del octeto.
Excepciones de regla de octeto
Tan importante y útil como la regla del octeto es en el enlace químico, existen muchas moléculas covalentes con átomos centrales que no tienen ocho electrones en sus estructuras de Lewis. Esto no quiere decir que la regla del octeto sea inútil, sino todo lo contrario. Como ocurre con muchas reglas, hay excepciones, o violaciones. Estas moléculas se clasifican en tres categorías:
- Las moléculas de electrones impares tienen un número impar de electrones de valencia y, por lo tanto, tienen un electrón desapareado.
- Las moléculas deficientes en electrones (octeto disminuido) tienen un átomo central que tiene menos electrones de los necesarios para una configuración de gas noble.
- Las moléculas de octeto expandido (hipervalentes) tienen un átomo central que tiene más electrones de los necesarios para una configuración de gas noble.
Moléculas de electrones impares
Aunque son pocos, algunos compuestos estables, a menudo llamados radicales libres, tienen un número impar de electrones en sus conchas de valencia. Con un número impar de electrones, al menos un átomo en la molécula tendrá que violar la regla del octeto. Ejemplos de moléculas estables de electrones impares son\(\ce{NO}\),\(\ce{NO2}\), y\(\ce{ClO2}\). El diagrama de puntos electrónicos de Lewis para\(\ce{NO}\), un compuesto producido en motores de combustión interna cuando el oxígeno y el nitrógeno reaccionan a altas temperaturas, es el siguiente:
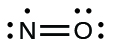
Como se puede ver, el nitrógeno y el oxígeno comparten cuatro electrones entre ellos. El átomo de oxígeno tiene un octeto de electrones pero el átomo de nitrógeno tiene sólo siete electrones de valencia, dos electrones en el doble enlace, un par solitario y un electrón solitario adicional. Aunque\(\ce{NO}\) is a stable compound, it is very chemically reactive, as are most other odd-electron compounds.
Electron-deficient molecules
These stable compounds have less than eight electrons around an atom in the molecule, i.e. they have less than an octet. The most common examples are the covalent compounds of beryllium and boron. For example, beryllium can form two covalent bonds, resulting in only four electrons in its valence shell:
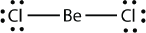
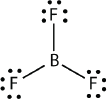
Boron commonly makes only three covalent bonds, resulting in only six valence electrons around the \(\ce{B}\) atom. A well-known example is \(\ce{BF3}\):
Expanded Octet Molecules
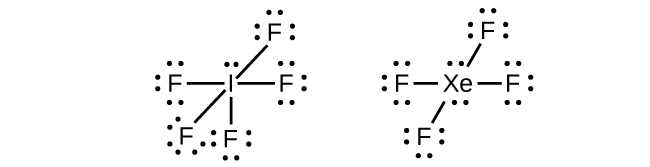
Elements in the second period of the periodic table (n = 2) can accommodate only eight electrons in their valence shell orbitals because they have only four valence orbitals (one 2s and three 2p orbitals). Elements in the third and higher periods (n ≥ 3) have more than four valence orbitals and can share more than four pairs of electrons with other atoms because they have empty d orbitals in the same shell. Molecules formed from these elements have expanded octets and are sometimes called hypervalent molecules. Phosphorous pentachloride shares five pairs of electrons for a total of ten electrons in the valence shell.

In some expanded octet molecules, such as IF5 and XeF4, some of the electrons in the outer shell of the central atom are lone pairs:
Identify each violation to the octet rule by drawing a Lewis electron dot diagram.
- \(\ce{ClO}\)
- \(\ce{SF6}\)
Solution
- With one Cl atom and one O atom, this molecule has 6 + 7 = 13 valence electrons, so it is an odd-electron molecule. A Lewis electron dot diagram for this molecule is as follows:
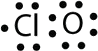
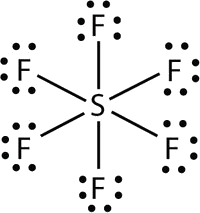
- In \(\ce{SF6}\), the central \(\ce{S}\) atom makes six covalent bonds to the six surrounding F atoms, so it is an expanded valence shell molecule. Its Lewis electron dot diagram is as follows:
Identify the violation to the octet rule in \(\ce{XeF2}\) by drawing a Lewis electron dot diagram.
- Answer
-
The Xe atom has an expanded valence shell with more than eight electrons around it.

Concept Review Exercises
-
How is a covalent bond formed between two atoms?
-
How does covalent bonding allow atoms in group 6A to satisfy the octet rule?
Answers
-
Covalent bonds are formed by two atoms sharing electrons.
-
The atoms in group 6A make two covalent bonds.

