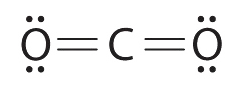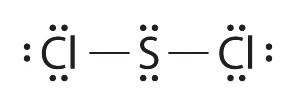4.7: Dibujo de estructuras de Lewis
- Page ID
- 72760
Objetivos de aprendizaje
- Dibujar estructuras de Lewis para moléculas.
Para moléculas e iones moleculares muy simples, podemos escribir las estructuras de Lewis simplemente emparejando los electrones desapareados en los átomos constituyentes. Vea estos ejemplos:
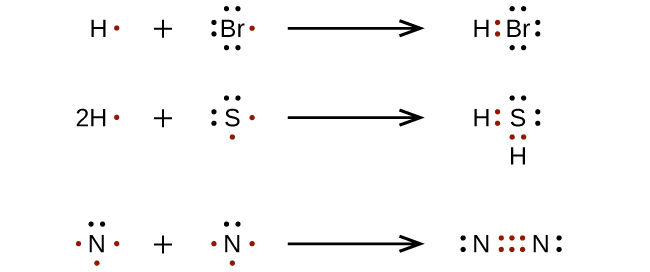
Para moléculas más complicadas, es útil seguir el procedimiento paso a paso descrito aquí:
- Organizar los átomos para mostrar conexiones específicas. Cuando hay un átomo central, suele ser el elemento menos electronegativo en el compuesto. Los químicos suelen enumerar este átomo central primero en la fórmula química (como en CCl 4 y CO 3 2 −, que ambos tienen C como átomo central), que es otra pista de la estructura del compuesto. El hidrógeno y los halógenos casi siempre están conectados a un solo átomo más, por lo que suelen ser terminales en lugar de centrales.
- Determinar el número total de electrones de valencia en la molécula o ion. Sumar los electrones de valencia de cada átomo. (Recordemos que el número de electrones de valencia está indicado por la posición del elemento en la tabla periódica.) Si la especie es un ion poliatómico, recuerde sumar o restar el número de electrones necesarios para dar la carga total sobre el ion. Para CO 3 2 −, por ejemplo, agregamos dos electrones al total debido a la carga −2.
- Colocar un par de electrones de unión entre cada par de átomos adyacentes para dar un enlace sencillo. En H 2 O, por ejemplo, hay un par de enlaces de electrones entre el oxígeno y cada hidrógeno.
- Comenzando con los átomos terminales, añadir suficientes electrones a cada átomo para dar a cada átomo un octeto (dos para hidrógeno). Estos electrones suelen ser pares solitarios.
- Si sobran electrones, colóquelos en el átomo central. Explicaremos más adelante que algunos átomos son capaces de acomodar más de ocho electrones.
- Si el átomo central tiene menos electrones que un octeto, use pares solitarios de átomos terminales para formar múltiples (dobles o triples) enlaces al átomo central para lograr un octeto. Esto no cambiará el número de electrones en los átomos terminales.
Ahora apliquemos este procedimiento a algunos compuestos particulares.
El átomo central suele ser el elemento menos electronegativo en la molécula o ion; el hidrógeno y los halógenos suelen ser terminales.
La\(H_2O\) Molécula
- Debido a que los átomos de H son casi siempre terminales, la disposición dentro de la molécula debe ser HOH.
- Cada átomo H (grupo 1) tiene 1 electrón de valencia, y el átomo O (grupo 16) tiene 6 electrones de valencia, para un total de 8 electrones de valencia.
- Colocar un par de electrones de unión entre el átomo de O y cada átomo de H da H:O:H, con 4 electrones sobrantes.
- Cada átomo H tiene una capa de valencia completa de 2 electrones.
- Agregar los 4 electrones restantes al oxígeno (como dos pares solitarios) da la siguiente estructura:

Debido a que esta estructura le da al oxígeno un octeto y a cada hidrógeno dos electrones, no necesitamos usar el paso 6.
El\(OCl^−\) Ion
- Con sólo dos átomos en la molécula, no hay átomo central.
- El oxígeno (grupo 16) tiene 6 electrones de valencia, y el cloro (grupo 17) tiene 7 electrones de valencia; debemos agregar uno más para la carga negativa sobre el ion, dando un total de 14 electrones de valencia.
- Colocar un par de electrones de unión entre O y Cl da O:Cl, con 12 electrones sobrantes.
- Si colocamos seis electrones (como tres pares solitarios) en cada átomo, obtenemos la siguiente estructura:
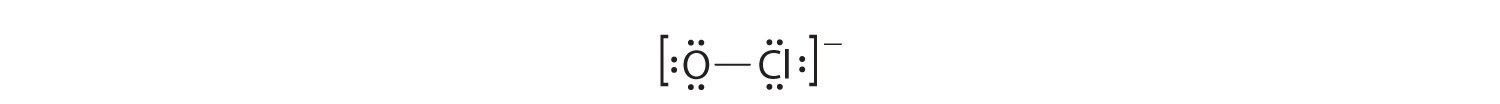
Cada átomo tiene ahora un octeto de electrones, por lo que no se necesitan los pasos 5 y 6. La estructura de electrones de Lewis se dibuja entre paréntesis como es habitual para un ion molecular, con la carga general indicada fuera de los paréntesis, y el par de electrones de unión se indica mediante una línea continua. OCl − es el ion hipoclorito, el ingrediente activo en la lejía con cloro para lavar ropa y en el desinfectante de piscinas.
La\(CH_2O\) Molécula
1. Debido a que el carbono es menos electronegativo que el oxígeno y el hidrógeno es normalmente terminal, C debe ser el átomo central. Una disposición posible es la siguiente:

2. Cada átomo de hidrógeno (grupo 1) tiene un electrón de valencia, el carbono (grupo 14) tiene 4 electrones de valencia y el oxígeno (grupo 16) tiene 6 electrones de valencia, para un total de [(2) (1) + 4 + 6] = 12 electrones de valencia.
3. La colocación de un par de electrones de unión entre cada par de átomos unidos da lo siguiente:

Se utilizan seis electrones y quedan 6.
4. Agregar los 6 electrones restantes al oxígeno (como tres pares solitarios) da lo siguiente:

Aunque ahora el oxígeno tiene un octeto y cada hidrógeno tiene 2 electrones, el carbono solo tiene 6 electrones.
5. No quedan electrones para colocar sobre el átomo central.
6. Para darle al carbono un octeto de electrones, usamos uno de los pares solitarios de electrones en el oxígeno para formar un doble enlace carbono-oxígeno:

Tanto el oxígeno como el carbono tienen ahora un octeto de electrones, por lo que esta es una estructura de electrones de Lewis aceptable. El O tiene dos pares de unión y dos pares solitarios, y C tiene cuatro pares de unión. Esta es la estructura del formaldehído, que se utiliza en el fluido de embalsamamiento.
Escriba la estructura de electrones de Lewis para cada especie.
- NCl 3
- S 2 2 −
- NoCl
Dado: especies químicas
Preguntado por: Estructuras de electrones de Lewis
Estrategia:
Utilice el procedimiento de seis pasos para escribir la estructura de electrones de Lewis para cada especie.
Solución:
- El nitrógeno es menos electronegativo que el cloro, y los átomos de halógeno suelen ser terminales, por lo que el nitrógeno es el átomo central. El átomo de nitrógeno (grupo 15) tiene 5 electrones de valencia y cada átomo de cloro (grupo 17) tiene 7 electrones de valencia, para un total de 26 electrones de valencia. El uso de 2 electrones por cada enlace N—Cl y la adición de tres pares solitarios a cada Cl representan (3 × 2) + (3 × 2 × 3) = 24 electrones. La regla 5 nos lleva a colocar los 2 electrones restantes en el N central:
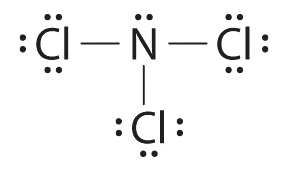
El tricloruro de nitrógeno es un líquido oleoso inestable que alguna vez se usó para blanquear la harina; este uso ahora está prohibido en Estados Unidos.
- En una molécula diatómica o ion, no necesitamos preocuparnos por un átomo central. Cada átomo de azufre (grupo 16) contiene 6 electrones de valencia, y necesitamos agregar 2 electrones para la carga −2, dando un total de 14 electrones de valencia. Usando 2 electrones para el enlace S-S, organizamos los 12 electrones restantes como tres pares solitarios en cada azufre, dando a cada átomo S un octeto de electrones:

- Debido a que el nitrógeno es menos electronegativo que el oxígeno o el cloro, es el átomo central. El átomo de N (grupo 15) tiene 5 electrones de valencia, el átomo O (grupo 16) tiene 6 electrones de valencia, y el átomo de Cl (grupo 17) tiene 7 electrones de valencia, dando un total de 18 electrones de valencia. Colocar un par de electrones de enlace entre cada par de átomos unidos usa 4 electrones y da lo siguiente:
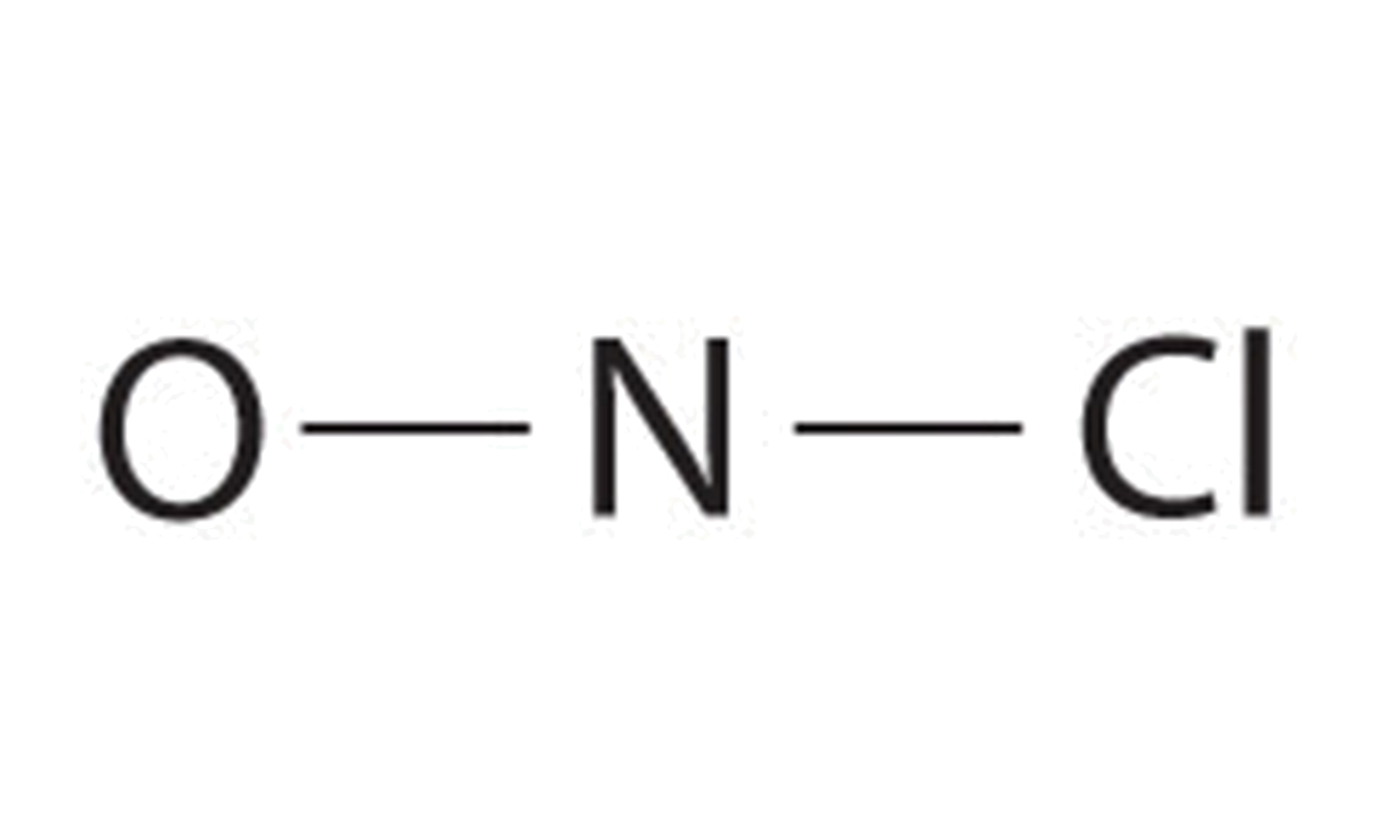
Agregar tres pares solitarios cada uno al oxígeno y al cloro usa 12 electrones más, dejando 2 electrones para colocar como un par solitario en nitrógeno:
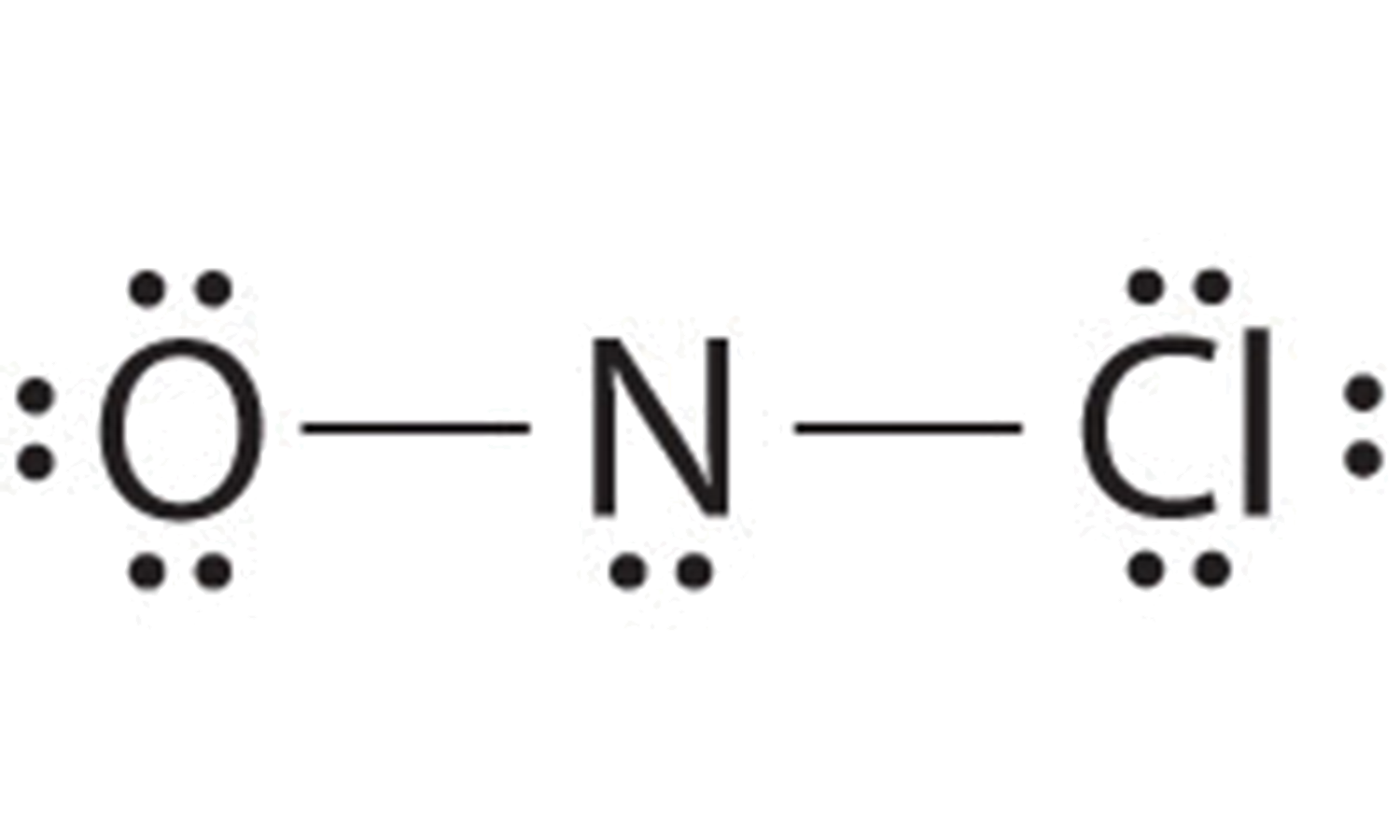
Debido a que esta estructura de Lewis tiene solo 6 electrones alrededor del nitrógeno central, se debe usar un par solitario de electrones en un átomo terminal para formar un par de enlace. Podríamos usar un par solitario en O o Cl. Debido a que hemos visto muchas estructuras en las que O forma un doble enlace pero ninguna con un doble enlace a Cl, es razonable seleccionar un par solitario de O para dar lo siguiente:
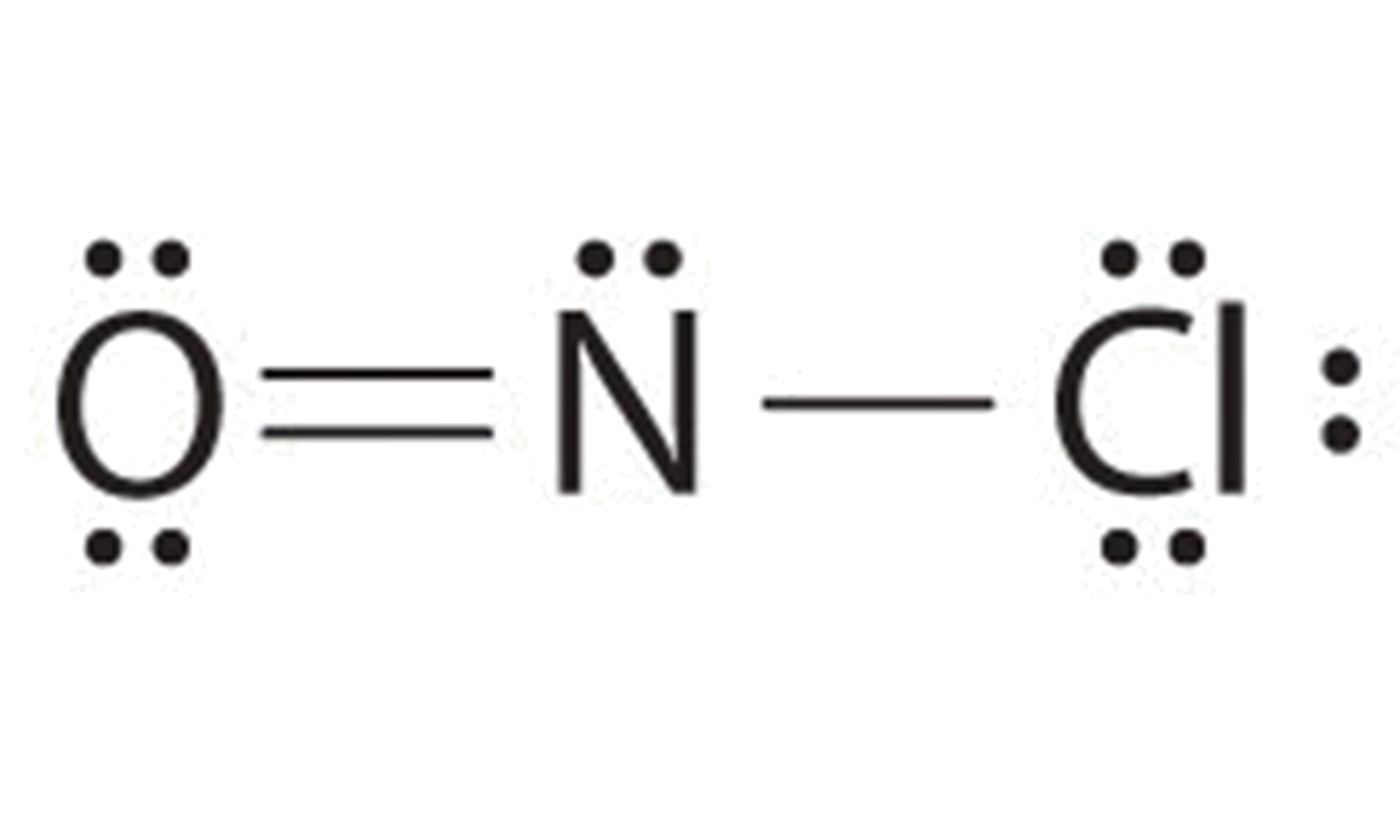
Todos los átomos ahora tienen configuraciones de octeto. Esta es la estructura electrónica de Lewis del cloruro de nitrosil, un gas altamente corrosivo, de color naranja rojizo.
Escriba estructuras de electrones de Lewis para CO 2 y SCl 2, un líquido rojo inestable con olor a vil que se utiliza en la fabricación de caucho.
Contestar