4.6: Fórmulas moleculares y estructuras de Lewis
- Page ID
- 72799
- Entender las diferentes formas de representar las moléculas.
Hay muchos “lenguajes universales” en el mundo. Músicos de todas las culturas reconocen la música plasmada en una serie de notas en un pentagrama. Este pasaje de una suite de violonchelo Bach podría ser interpretado por cualquier músico entrenado de cualquier país, porque hay un acuerdo en cuanto a lo que significan los símbolos de la página. De la misma manera, las moléculas se representan utilizando símbolos y un lenguaje en el que coinciden todos los químicos.
Fórmulas moleculares
Una fórmula molecular es una fórmula química de un compuesto molecular que muestra los tipos y números de átomos presentes en una molécula del compuesto. El amoníaco es un compuesto de nitrógeno e hidrógeno como se muestra a continuación:
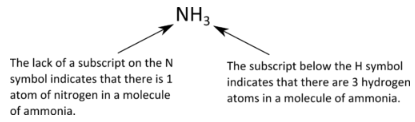
Obsérvese del ejemplo que existen algunas reglas estándar a seguir al escribir fórmulas moleculares. El número de átomos de cada tipo se indica mediante un subíndice que sigue al átomo. Si sólo hay un átomo, no se escribe ningún número. Si hay más de un átomo de un tipo específico, el número se escribe como un subíndice que sigue al átomo. No escribiríamos\(\ce{N_3H}\) para amoníaco, porque eso significaría que hay tres átomos de nitrógeno y un átomo de hidrógeno en la molécula, lo cual es incorrecto.
Si bien es útil para describir una molécula, la fórmula molecular no nos dice nada sobre la forma de la molécula, dónde están los diferentes átomos, o qué tipo de enlaces se forman. Las fórmulas estructurales son mucho más útiles para comunicar información más detallada sobre una molécula porque muestran qué átomos están unidos entre sí y, en algunos casos, la disposición aproximada de los átomos en el espacio. Conocer la fórmula estructural de un compuesto permite a los químicos crear un modelo tridimensional, que proporciona información sobre cómo se comportará ese compuesto física y químicamente.
La figura\(\PageIndex{3}\) muestra algunas de las diferentes formas de retratar la estructura de una molécula ligeramente más compleja: el metanol. Estas representaciones difieren mucho en su contenido de información. Por ejemplo, la fórmula molecular para metanol (Figura\(\PageIndex{3a}\)) da solo el número de cada tipo de átomo; escribir metanol como CH 4 O no dice nada sobre su estructura. En contraste, la fórmula estructural (Figura\(\PageIndex{3b}\)) indica cómo están conectados los átomos, pero hace que el metanol se vea como si fuera plano (lo cual no lo es). Tanto el modelo de bola y palo (parte (c) en la Figura\(\PageIndex{3}\)) como el dibujo en perspectiva (Figura\(\PageIndex{3d}\)) muestran la estructura tridimensional de la molécula. Esta última (también llamada representación de cuña y guión) es la forma más fácil de esbozar la estructura de una molécula en tres dimensiones. Muestra qué átomos están por encima y por debajo del plano del papel mediante el uso de cuñas y guiones, respectivamente; siempre se supone que el átomo central está en el plano del papel. El modelo de relleno de espacio (parte (e) en la Figura\(\PageIndex{3}\)) ilustra los tamaños relativos aproximados de los átomos en la molécula, pero no muestra los enlaces entre los átomos. Además, en un modelo de relleno de espacio, los átomos en el “frente” de la molécula pueden oscurecer los átomos en la “parte posterior”.
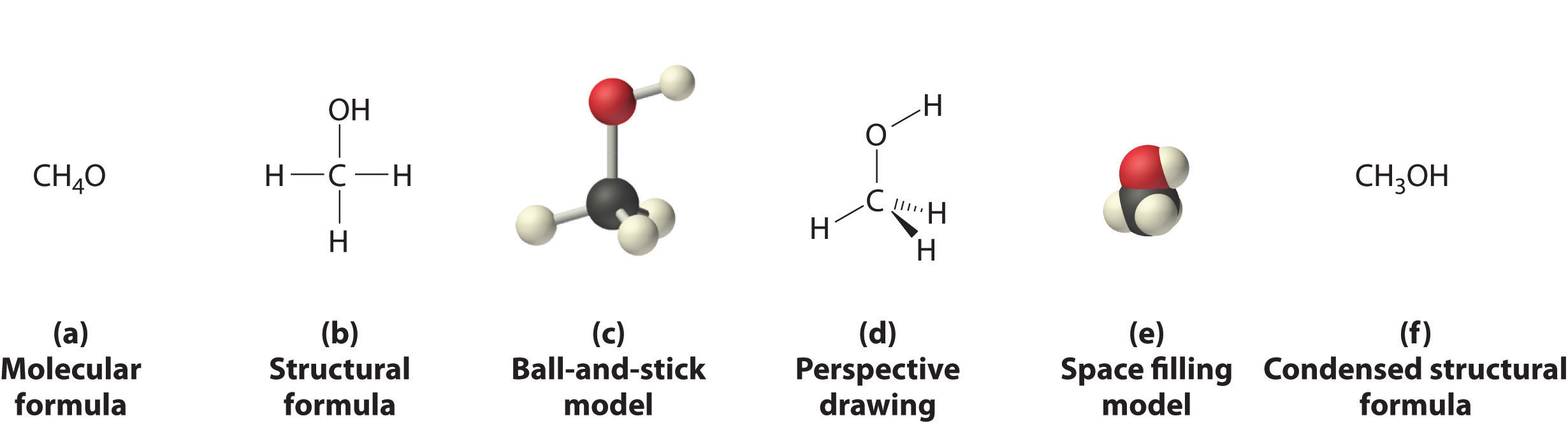
Aunque una fórmula estructural, un modelo de bola y varilla, un dibujo en perspectiva y un modelo de relleno de espacio proporcionan una cantidad significativa de información sobre la estructura de una molécula, cada uno requiere tiempo y esfuerzo. En consecuencia, los químicos suelen utilizar una fórmula estructural condensada (parte (f) en la Figura\(\PageIndex{3}\)), que omite las líneas que representan enlaces entre átomos y simplemente enumera los átomos unidos a un átomo dado junto a él. Múltiples grupos unidos al mismo átomo se muestran entre paréntesis, seguido de un subíndice que indica el número de dichos grupos. Por ejemplo, la fórmula estructural condensada para metanol es CH 3 OH, lo que indica que la molécula contiene una unidad CH 3 que parece un fragmento de metano (CH 4). Por lo tanto, el metanol puede verse como una molécula de metano en la que un átomo de hidrógeno ha sido reemplazado por un grupo —OH o como una molécula de agua en la que un átomo de hidrógeno ha sido reemplazado por un fragmento —CH 3. Debido a su facilidad de uso y contenido de información, utilizamos fórmulas estructurales condensadas para moléculas a lo largo de este texto. Los modelos de bola y varilla se utilizan cuando es necesario para ilustrar la estructura tridimensional de las moléculas, y los modelos de relleno de espacio se usan solo cuando es necesario visualizar los tamaños relativos de átomos o moléculas para comprender un punto importante.
Escriba la fórmula molecular para cada compuesto. Se da la fórmula estructural condensada.
- El monocloruro de azufre (también llamado dicloruro de disulfur) es un líquido amarillo corrosivo de olor vil utilizado en la producción de caucho sintético. Su fórmula estructural condensada es ClSSCl.
- El etilenglicol es el ingrediente principal en el anticongelante. Su fórmula estructural condensada es HOCH 2 CH 2 OH.
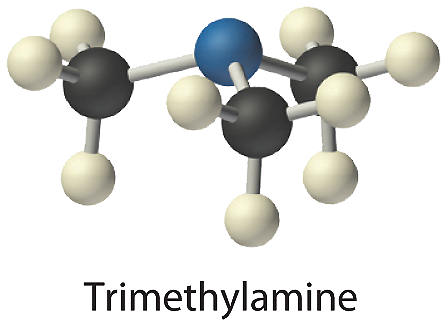
- La trimetilamina es una de las sustancias responsables del olor del pescado en mal estado. Su fórmula estructural condensada es (CH 3) 3 N.
Dado: fórmula estructural condensada
Preguntado por: fórmula molecular
Estrategia:
- Identificar cada elemento en la fórmula estructural condensada y luego determinar si el compuesto es orgánico o inorgánico.
- En su caso, utilice convención orgánica o inorgánica para enumerar los elementos. Luego agregue los subíndices apropiados para indicar el número de átomos de cada elemento presente en la fórmula molecular.
Solución:
La fórmula molecular enumera los elementos en la molécula y el número de átomos de cada uno.
- A Cada molécula de monocloruro de azufre tiene dos átomos de azufre y dos átomos de cloro. Debido a que no contiene principalmente carbono e hidrógeno, es un compuesto inorgánico. B El azufre se encuentra a la izquierda del cloro en la tabla periódica, por lo que se escribe primero en la fórmula. La adición de subíndices da la fórmula molecular S 2 Cl 2.
- A Contando los átomos en etilenglicol, obtenemos seis átomos de hidrógeno, dos átomos de carbono y dos átomos de oxígeno por molécula. El compuesto consiste principalmente en átomos de carbono e hidrógeno, por lo que es orgánico. B Al igual que con todos los compuestos orgánicos, C y H se escriben primero en la fórmula molecular. La adición de subíndices apropiados da la fórmula molecular C 2 H 6 O 2.
- A La fórmula estructural condensada muestra que la trimetilamina contiene tres unidades CH 3, por lo que tenemos un átomo de nitrógeno, tres átomos de carbono y nueve átomos de hidrógeno por molécula. Debido a que la trimetilamina contiene principalmente carbono e hidrógeno, es un compuesto orgánico. B De acuerdo con la convención para compuestos orgánicos, C y H se escriben primero, dando la fórmula molecular C 3 H 9 N.
Escribe la fórmula molecular para cada molécula.
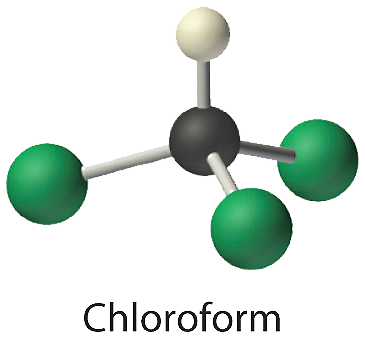
- El cloroformo, que fue uno de los primeros anestésicos y se utilizó en muchos jarabes para la tos hasta hace poco, contiene un átomo de carbono, un átomo de hidrógeno y tres átomos de cloro. Su fórmula estructural condensada es\(\ce{CHCl3}\).
- La hidrazina se utiliza como propulsor en los chorros de actitud del transbordador espacial. Su fórmula estructural condensada es\(\ce{H2NNH2}\).
- La putrescina es un compuesto de olor penetrante aislado primero de extractos de carne podrida. Su fórmula estructural condensada es H2NCH2CH2CH2CH2NH2. Esto a menudo se escribe\(\ce{H2N(CH2)4NH2}\) para indicar que hay cuatro fragmentos CH2 unidos entre sí.
- Contestar a
-
CHCl 3
- Respuesta b
-
N 2 H 4
- Respuesta c
-
C 4 H 12 N 2

