4.8: Las formas de las moléculas
- Page ID
- 72818
Objetivos de aprendizaje
- Predecir las estructuras de moléculas pequeñas usando la teoría de repulsión de pares de electrones de capa de valencia (VSEPR).
El enfoque de pares de electrones de Lewis se puede utilizar para predecir el número y los tipos de enlaces entre los átomos en una sustancia, e indica qué átomos tienen pares solitarios de electrones. Sin embargo, este enfoque no da información sobre la disposición real de los átomos en el espacio. Continuamos nuestra discusión sobre la estructura y la unión introduciendo el modelo de repulsión de pares de electrones de capa de valencia (VSEPR) (pronunciado “vesper”), que puede usarse para predecir las formas de muchas moléculas e iones poliatómicos. Tenga en cuenta, sin embargo, que el modelo VSEPR, como cualquier modelo, es una representación limitada de la realidad; el modelo no proporciona información sobre la longitud de los enlaces o la presencia de múltiples enlaces.
El modelo VSEPR
El modelo VSEPR puede predecir la estructura de casi cualquier molécula o ion poliatómico en el que el átomo central es un no metal, así como las estructuras de muchas moléculas e iones poliatómicos con un átomo metálico central. La premisa de la teoría VSEPR es que los pares de electrones ubicados en enlaces y pares solitarios se repelen entre sí y por lo tanto adoptarán la geometría que coloca a los pares de electrones lo más lejos posible entre sí. Esta teoría es muy simplista y no da cuenta de las sutilezas de las interacciones orbitales que influyen en las formas moleculares; sin embargo, el simple procedimiento de conteo VSEPR predice con precisión las estructuras tridimensionales de un gran número de compuestos, lo que no se puede predecir usando el par de electrones de Lewis enfoque.
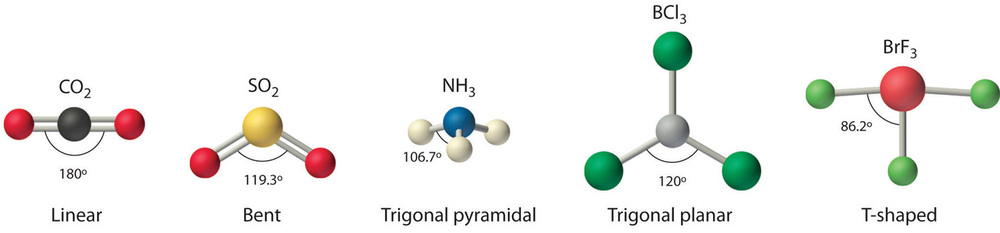
Podemos usar el modelo VSEPR para predecir la geometría de la mayoría de las moléculas e iones poliatómicos enfocándonos únicamente en el número de pares de electrones alrededor del átomo central, ignorando todos los demás electrones de valencia presentes. Según este modelo, los electrones de valencia en la estructura de Lewis forman grupos de electrones (regiones de densidad electrónica), que pueden consistir en un enlace sencillo, un doble enlace, un triple enlace, un par solitario de electrones, o incluso un solo electrón desapareado, que en el modelo VSEPR se cuenta como un par solitario. Debido a que los electrones se repelen electrostáticamente, la disposición más estable de los grupos de electrones (es decir, el que tiene la energía más baja) es la que minimiza las repulsiones. Los grupos se posicionan alrededor del átomo central de una manera que produce la estructura molecular con la energía más baja, como se ilustra en la Figura\(\PageIndex{1}\).
Es importante señalar que la geometría del grupo de electrones alrededor de un átomo central no es lo mismo que su estructura molecular. Las geometrías de grupos de electrones describen todas las regiones donde se encuentran los electrones, los enlaces y los pares solitarios. La estructura molecular describe la ubicación de los átomos solos, sin incluir los electrones del par solitario.
Diferenciamos entre estas dos situaciones nombrando la geometría que incluye a todos los pares de electrones la geometría del grupo de electrones. La estructura que incluye solo la colocación de los átomos en la molécula se denomina estructura molecular (o forma molecular). Las geometrías del grupo de electrones serán las mismas que las estructuras moleculares cuando no haya pares de electrones solitarios alrededor del átomo central, pero serán diferentes cuando haya pares solitarios presentes en el átomo central.
El siguiente procedimiento utiliza la teoría VSEPR para determinar la geometría del grupo de electrones y las estructuras moleculares (forma molecular):
- Dibujar la estructura de Lewis de la molécula o ion poliatómico.
- Contar el número de grupos de electrones o regiones de densidad electrónica (pares solitarios y enlaces) alrededor del átomo central. Un enlace simple, doble o triple cuenta como un grupo de electrones.
- Determine la geometría del grupo de electrones colocando los grupos lo más separados posible.
- Determinar la estructura molecular (observando únicamente los grupos enlazados).
La tabla\(\PageIndex{1}\) resume las formas de las moléculas con base en el número de grupos de electrones y átomos circundantes.
| Número de grupos de electrones en el átomo central | Número de grupos de unión | Número de Pares Solitarios | Geometría del grupo de electrones | Estructura Molecular |
|---|---|---|---|---|
| 2 | 2 | 0 | lineal | lineal |
| 3 | 3 | 0 | plano trigonal | plano trigonal |
| 3 | 2 | 1 | plano trigonal | doblado 120° |
| 4 | 4 | 0 | tetraédrico | tetraédrico |
| 4 | 3 | 1 | tetraédrico | piramidal trigonal |
| 4 | 2 | 2 | tetraédrico | doblado 109° |
Dos grupos de electrones
Cualquier molécula con solo dos átomos es lineal. Una molécula cuyo átomo central contiene solo dos grupos de electrones orienta esos dos grupos lo más lejos posible entre sí, que está separados 180°. Cuando los dos grupos de electrones están separados 180°, los átomos unidos a esos grupos de electrones también están separados 180°, por lo que la estructura molecular general es lineal. Los ejemplos incluyen BeH 2 y CO 2:

Tres grupos de electrones
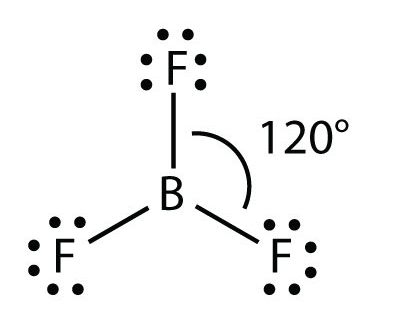
Una molécula con tres grupos de electrones orienta los tres grupos lo más lejos posible. Adoptan las posiciones de un triángulo equilátero, separados 120° y en un plano. La forma de tales moléculas es plana trigonal. Un ejemplo es BF 3:
Algunas sustancias tienen una distribución de grupos electrónicos planos trigonales pero tienen átomos unidos a solo dos de los tres grupos de electrones. Un ejemplo es GEF 2:
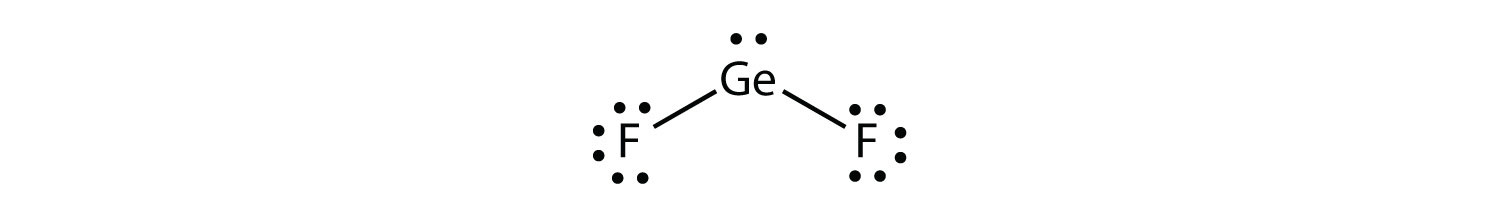
Desde la perspectiva de la geometría del grupo de electrones, el GEF 2 tiene una forma plana trigonal, pero su forma real está dictada por las posiciones de los átomos. Esta estructura molecular se denomina doblada 120° o angular.
Cuatro grupos de electrones
Una molécula con cuatro grupos de electrones alrededor del átomo central orienta los cuatro grupos en la dirección de un tetraedro con ángulos de enlace de aproximadamente 109.5°. Si hay cuatro átomos unidos a estos grupos de electrones, entonces la estructura molecular también es tetraédrica. El metano (CH 4) es un ejemplo.
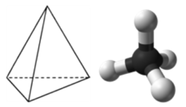
Este diagrama de CH 4 ilustra la convención estándar de mostrar una molécula tridimensional en una superficie bidimensional. Las líneas rectas están en el plano de la página, la línea acuñada sólida sale del plano hacia el lector, y la línea acuñada discontinua sale del plano alejándose del lector.
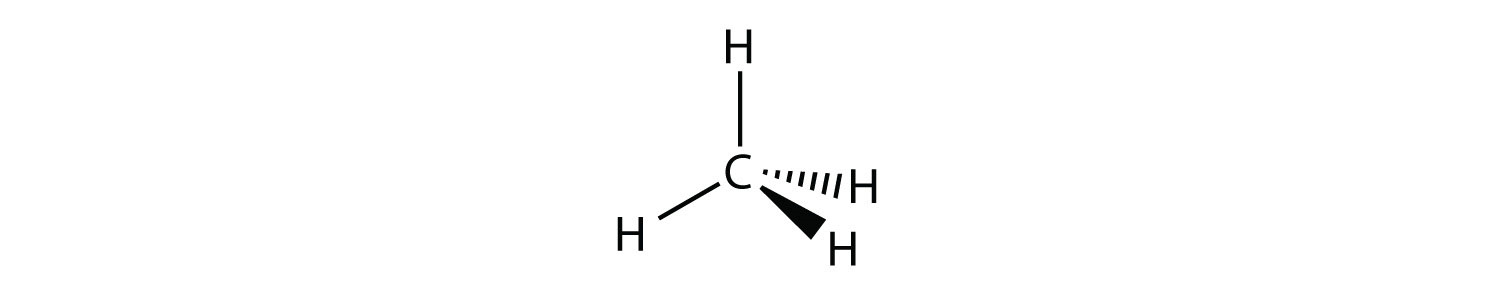
NH 3 es un ejemplo de una molécula cuyo átomo central tiene cuatro grupos de electrones, pero sólo tres de ellos están unidos a átomos circundantes.
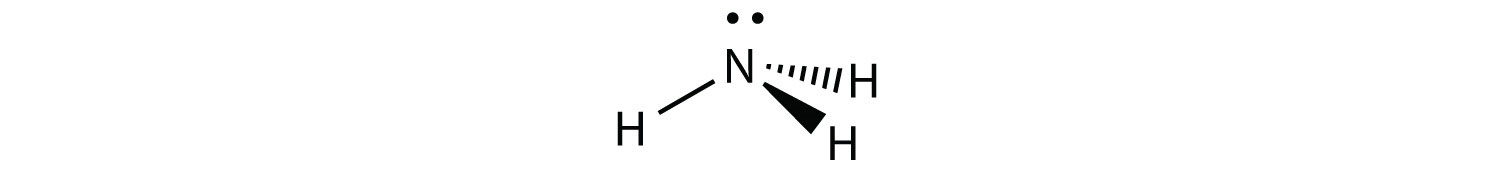
Aunque los grupos de electrones están orientados en forma de tetraedro, desde una perspectiva de geometría molecular, la forma del NH 3 es piramidal trigonal.
H 2 O es un ejemplo de una molécula cuyo átomo central tiene cuatro grupos de electrones, pero sólo dos de ellos están unidos a átomos circundantes.
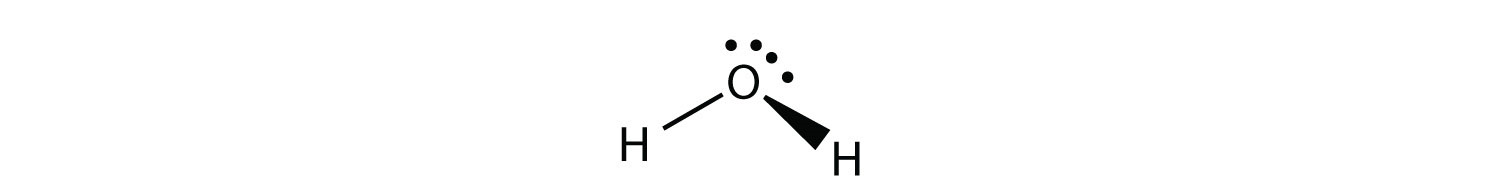
Aunque los grupos de electrones están orientados en forma de tetraedro, la forma de la molécula es doblada 109° o angular. Una molécula con cuatro grupos de electrones alrededor del átomo central, pero solo un grupo de electrones unido a otro átomo, es lineal porque solo hay dos átomos en la molécula.
Formas de Moléculas con Doble o Triple Enlace
Los enlaces dobles o triples cuentan como un solo grupo de electrones. El diagrama de puntos electrónicos de Lewis del formaldehído (CH 2 O) se muestra en la Figura\(\PageIndex{9}\).
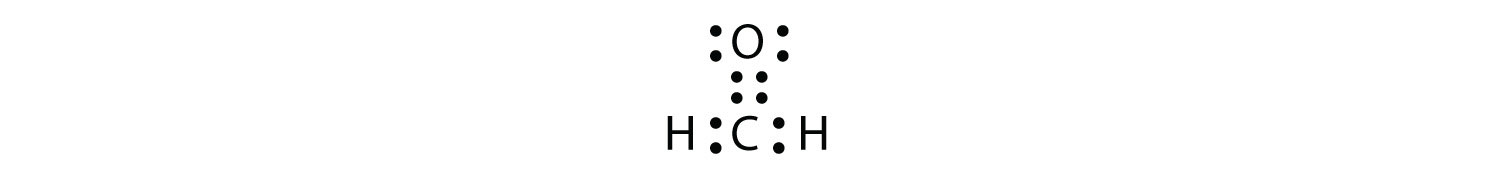
El átomo de C central tiene tres grupos de electrones a su alrededor porque el doble enlace cuenta como un grupo de electrones. Los tres grupos de electrones se repelen entre sí para adoptar una forma plana trigonal.
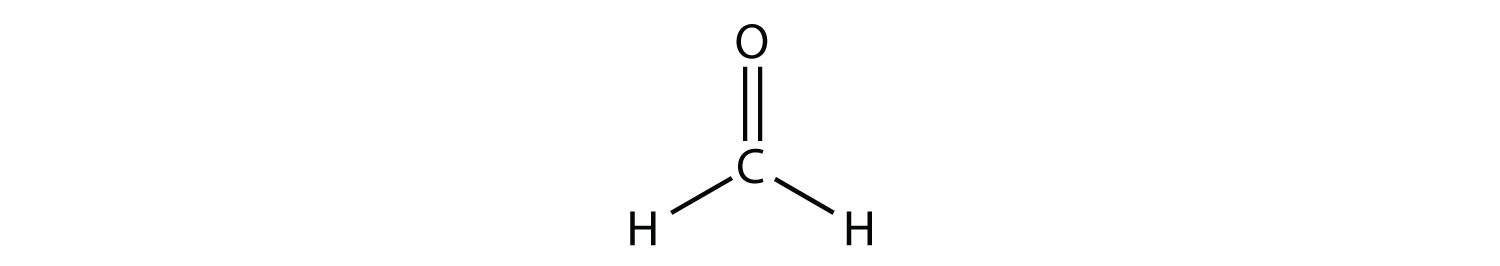
(Los pares de electrones solitarios en el átomo de O se omiten para mayor claridad). La molécula no será un triángulo equilátero perfecto porque el doble enlace C-O es diferente de los dos enlaces C-H, pero tanto plano como triangular describen la forma aproximada apropiada de esta molécula.
¿Cuál es la forma aproximada de cada molécula?
- PCl 3
- NOF
Solución
El primer paso es dibujar la estructura de Lewis de la molécula.
Para\(\ce{PCl3}\), el diagrama de puntos electrónicos es el siguiente:
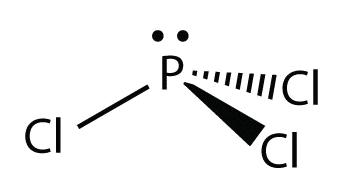
Los pares de electrones solitarios en los átomos de Cl se omiten para mayor claridad. El átomo P tiene cuatro grupos de electrones con tres de ellos unidos a los átomos circundantes, por lo que la forma molecular es piramidal trigonal.
El diagrama de puntos electrónicos para\(\ce{NOF}\) es el siguiente:
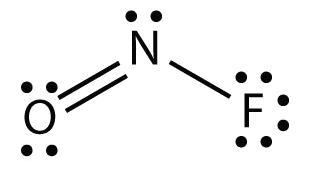
El átomo de N tiene tres grupos de electrones en él, dos de los cuales están unidos a otros átomos. La forma molecular está doblada.
¿Cuál es la forma molecular aproximada de\(\ce{CH2Cl2}\)?
- Responder
-
Tetraédrico
El etileno (\(\ce{C2H4}\)) tiene dos átomos centrales. Determinar la geometría alrededor de cada átomo central y la forma de la molécula general. (Pista: el hidrógeno es un átomo terminal.)
- Responder
-
Plano trigonal alrededor de ambos átomos de C centrales.
Moléculas con múltiples átomos centrales
El modelo VSEPR puede usarse para predecir la estructura de moléculas algo más complejas con más de un átomo central usando VSEPR como se describió anteriormente para cada átomo central individualmente. Demostraremos con isocianato de metilo (CH 3 —N=C=O), una molécula volátil y altamente tóxica que se utiliza para producir el pesticida Sevin.
Comience por observar los grupos de electrones alrededor del primer átomo de carbono a la izquierda, que está conectado a tres átomos de H y un átomo de N por enlaces simples. Hay cuatro grupos o electrones o cuatro enlaces alrededor del carbono. Por lo tanto, podemos predecir que la porción CH 3 —N de la molécula sea aproximadamente tetraédrica, similar al metano:
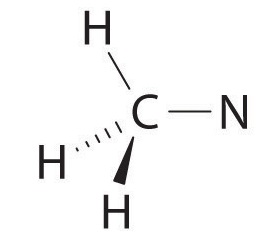
El átomo de nitrógeno está conectado a un carbono por un enlace sencillo y al otro carbono por un doble enlace, produciendo un total de tres enlaces, C—N=C. para que el nitrógeno tenga un octeto de electrones, también debe tener un par solitario:
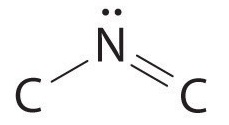
Debido a que los enlaces múltiples no se muestran en el modelo VSEPR, el nitrógeno está rodeado de manera efectiva por tres grupos de electrones. Así, de acuerdo con el modelo VSEPR, el fragmento C—N=C debe doblarse con un ángulo ~120°.
El carbono en el fragmento —N=C=O está doblemente unido tanto al nitrógeno como al oxígeno, lo que en el modelo VSEPR le da al carbono un total de dos pares de electrones. Por lo tanto, el ángulo N=C=O debe ser de 180°, o lineal. Los tres fragmentos se combinan para dar la siguiente estructura:
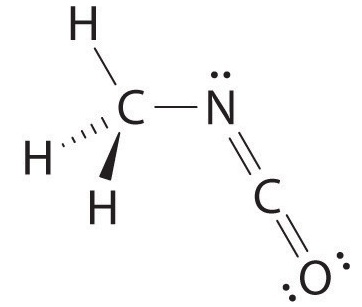
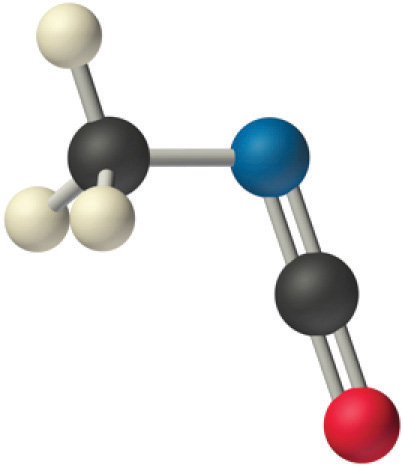
Se observan ciertos patrones en las estructuras de moléculas moderadamente complejas. Por ejemplo, los átomos de carbono con cuatro enlaces (como el carbono de la izquierda en el isocianato de metilo) son generalmente tetraédricos. De igual manera, el átomo de carbono de la derecha tiene dos dobles enlaces que son similares a los del CO 2, por lo que su geometría, como la del CO 2, es lineal. Reconocer similitudes con moléculas más simples te ayudará a predecir las geometrías moleculares de moléculas más complejas.
Utilizar el modelo VSEPR para predecir la geometría molecular del propino (H 3 C—C=CH), un gas con algunas propiedades anestésicas.
Dado: compuesto químico
Preguntado por: geometría molecular
Estrategia:
Contar el número de grupos de electrones alrededor de cada carbono, reconociendo que en el modelo VSEPR, un enlace múltiple cuenta como un solo grupo. Use Figura\(\PageIndex{3}\) para determinar la geometría molecular alrededor de cada átomo de carbono y luego deducir la estructura de la molécula como un todo.
Solución:
Debido a que el átomo de carbono de la izquierda está unido a otros cuatro átomos, sabemos que es aproximadamente tetraédrico. Los siguientes dos átomos de carbono comparten un triple enlace, y cada uno tiene un enlace sencillo adicional. Debido a que un enlace múltiple se cuenta como un enlace sencillo en el modelo VSEPR, cada átomo de carbono se comporta como si tuviera dos grupos de electrones. Esto significa que ambos carbonos son lineales, con ángulos C—C=C y C=C—H de 180°.
Predecir la geometría del aleno (H 2 C=C=CH 2), un compuesto con propiedades narcóticas que se utiliza para elaborar moléculas orgánicas más complejas.
- Responder
-
Los átomos de carbono terminales son planos trigonales, el carbono central es lineal y el ángulo C—C—C es 180°.

