6.2: Conversiones Gram-Mole
- Page ID
- 72964
Objetivos de aprendizaje
- Para convertir entre unidades de masa y unidades de moles.
Como acabamos de discutir, la masa molar se define como la masa (en gramos) de 1 mol de sustancia (o el número de moléculas o unidades de fórmula de Avogadro).
El tipo de manipulación más simple usando la masa molar como factor de conversión es una conversión mole-gramo (o su inversa, una conversión gramo-mol).
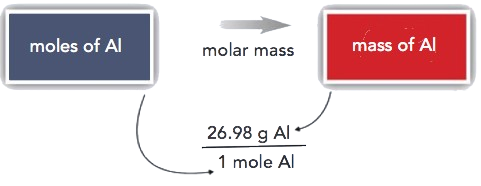
También se estableció que 1 mol de Al tiene una masa de 26.98 g (Ejemplo\(\PageIndex{1}\)). Declarado matemáticamente,
1 mol Al = 26.98 g Al
Podemos dividir ambos lados de esta expresión por cada lado para obtener uno de los dos posibles factores de conversión:
\[\mathrm{\dfrac{1\: mol\: Al}{26.98\: g\: Al}\quad and \quad \dfrac{26.98\: g\: Al}{1\: mol\: Al}} \nonumber\]
El primer factor de conversión se puede utilizar para convertir de masa a moles, y el segundo convierte de moles a masa. Ambos pueden ser utilizados para resolver problemas que serían difíciles de hacer “a simple vista”.
Ejemplo\(\PageIndex{1}\)
¿Cuál es la masa de 3.987 mol de Al?
Solución
El primer paso en un problema de conversión es decidir qué factor de conversión usar. Debido a que estamos comenzando con unidades de mole, queremos un factor de conversión que cancele la unidad de mole e introduzca la unidad para masa en el numerador. Por lo tanto, debemos usar el factor\(\mathrm{\dfrac{26.98\: g\: Al}{1\: mol\: Al}}\) de conversión. Comenzamos con la cantidad dada y multiplicamos por el factor de conversión:
\(\mathrm{3.987\: mol\: Al\times\dfrac{26.98\: g\: Al}{1\: mol\: Al}}\)
Tenga en cuenta que las unidades mol cancelan algebraicamente. (Se entiende que la cantidad 3.987 mol está en el numerador de una fracción que tiene 1 en el denominador no escrito.) Cancelación y resolución da
\(\mathrm{3.987\: mol\: Al\times \dfrac{26.98\: g\: Al}{1\: mol\: Al}=107.6\: g\: Al}\)
Nuestra respuesta final se expresa a cuatro cifras significativas.
Ejercicio\(\PageIndex{1}\)
¿Cuántos moles están presentes en 100.0 g de Al? (Pista: tendrás que usar el otro factor de conversión que obtuvimos para el aluminio.)
- Responder
- \(\mathrm{100.0\: g\: Al\times \dfrac{1\: mol\: Al}{26.98\: g\: Al}=3.706\: mol\: Al}\)
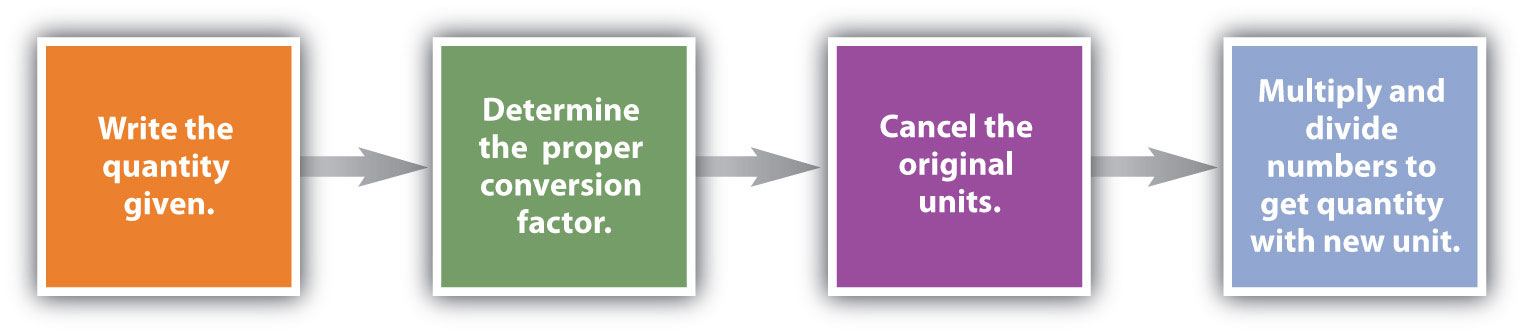
Conversiones como esta son posibles para cualquier sustancia, siempre y cuando se conozca (o pueda determinarse) la masa atómica adecuada, la masa de fórmula o la masa molar y se exprese en gramos por mol. La figura\(\PageIndex{1}\) es una gráfica para determinar qué factor de conversión se necesita, y la figura\(\PageIndex{2}\) es un diagrama de flujo para los pasos necesarios para realizar una conversión.

Ejemplo\(\PageIndex{2}\)
Un bioquímico necesita 0.00655 mol de bilirrubina (C 33 H 36 N 4 O 6) para un experimento. ¿Cuántos gramos de bilirrubina serán?
Solución
Para convertir de moles a masa, necesitamos la masa molar de bilirrubina, que podemos determinar a partir de su fórmula química:
| 33 C Masa molar: | 33 × 12.01 g = | 396.33 g |
| 36 H Masa molar: | 36 × 1.01 g = | 36.36 g |
| Masa molar 4 N: | 4 × 14.01 g = | 56.04 g |
| 6 O masa molar: | 6 × 16.00 g = | 96.00 g |
| Total: | 584.73 g |
La masa molar de bilirrubina es de 584.73 g. Usando la relación
1 mol de bilirrubina = 584.73 g de bilirrubina
podemos construir el factor de conversión apropiado para determinar cuántos gramos hay en 0.00655 mol. Siguiendo los pasos de la Figura\(\PageIndex{2}\):
\(\mathrm{0.00655\: mol\: bilirubin \times \dfrac{584.73\: g\: bilirubin}{mol\: bilirubin}=3.83\: g\: bilirubin}\)
La unidad mol de bilirrubina cancela. El bioquímico necesita 3.83 g de bilirrubina.
Ejercicio\(\PageIndex{2}\)
Un químico necesita 457.8 g de KMnO 4 para hacer una solución. ¿Cuántos moles de KMnO 4 es ese?
- Responder
- \(\mathrm{457.8\: g\: KMnO_4\times \dfrac{1\: mol\: KMnO_4}{158.04\: g\: KMnO_4}=2.897\: mol\: KMnO_4}\)
A Su Salud: Minerales
Para que nuestros cuerpos funcionen correctamente, necesitamos ingerir ciertas sustancias de nuestras dietas. Entre nuestras necesidades dietéticas se encuentran los minerales, los elementos no carbonados que nuestro cuerpo utiliza para una variedad de funciones, como desarrollar hueso o asegurar una transmisión nerviosa adecuada. El Departamento de Agricultura de Estados Unidos ha establecido algunas recomendaciones para las IDR de diversos minerales. En el cuadro adjunto se enumeran los IDR para minerales, tanto en masa como en moles, asumiendo una dieta diaria de 2,000 calorías.
| Mineral | Masculino (edad 19—30 años) | Femenino (edad 19—30 años) | ||
|---|---|---|---|---|
| Ca | 1,000 mg | 0.025 mol | 1,000 mg | 0.025 mol |
| Cr | 35 µg | 6.7 × 10 −7 mol | 25 µg | 4.8 × 10 −7 mol |
| Cu | 900 µg | 1.4 × 10 −5 mol | 900 µg | 1.4 × 10 −5 mol |
| F | 4 mg | 2.1 × 10 −4 mol | 3 mg | 1.5 × 10 −4 mol |
| I | 150 µg | 1.2 × 10 −6 m ol | 150 µg | 1.2 × 10 −6 mol |
| Fe | 8 mg | 1.4 × 10 −4 mol | 18 mg | 3.2 × 10 −4 mol |
| K | 3,500 mg | 9.0 × 10 −2 mol | 3,500 mg | 9.0 × 10 −2 mol |
| Mg | 400 mg | 1.6 × 10 −2 mol | 310 mg | 1.3 × 10 −2 mol |
| Mn | 2.3 mg | 4.2 × 10 −5 mol | 1.8 mg | 3.3 × 10 −5 mol |
| Mo | 45 mg | 4.7 × 10 −7 mol | 45 mg | 4.7 × 10 −7 mol |
| Na | 2,400 mg | 1.0 × 10 −1 mol | 2,400 mg | 1.0 × 10 −1 mol |
| P | 700 mg | 2.3 × 10 −2 mol | 700 mg | 2.3 × 10 −2 mol |
| Se | 55 µg | 7.0 × 10 −7 mol | 55 µg | 7.0 × 10 −7 mol |
| Zn | 11 mg | 1.7 × 10 −4 mol | 8 mg | 1.2 × 10 −4 mol |
Tabla\(\PageIndex{1}\) ilustra varias cosas. En primer lugar, las necesidades de hombres y mujeres para algunos minerales son diferentes. El caso extremo es para el hierro; las mujeres necesitan más del doble que los hombres. En todos los demás casos en los que existe una IDR diferente, los hombres necesitan más que las mujeres.
En segundo lugar, las cantidades de los diversos minerales necesarios diariamente varían ampliamente, tanto en una escala de masa como en una escala molar. La persona promedio necesita 0.1 mol de Na al día, lo que es aproximadamente 2.5 g. Por otro lado, una persona necesita solo alrededor de 25—35 µg de Cr por día, lo que es menos de una millonésima parte de un mol. Por pequeña que sea esta cantidad, una deficiencia de cromo en la dieta puede provocar síntomas similares a la diabetes o problemas neurológicos, especialmente en las extremidades (manos y pies). Para algunos minerales, el cuerpo no requiere mucho para mantenerse funcionando correctamente.
Si bien una dieta adecuadamente equilibrada proporcionará todos los minerales necesarios, algunas personas toman suplementos dietéticos. Sin embargo, demasiado de algo bueno, incluso minerales, no es bueno. La exposición a demasiado cromo, por ejemplo, causa irritación de la piel, y se sabe que ciertas formas de cromo causan cáncer (como se presenta en la película Erin Brockovich).

