7.2: Cambios de calor durante las reacciones químicas
- Page ID
- 72902
- Definir la energía de disociación del enlace.
- Determinar si un proceso químico es exotérmico o endotérmico.
Una afirmación general, basada en innumerables observaciones a lo largo de siglos de estudio, es que todos los objetos tienden a moverse espontáneamente a una posición de mínima energía a menos que actúese sobre ella por alguna otra fuerza u objeto.
Energía de disociación de enlaces
Los átomos se unen para formar compuestos porque al hacerlo obtienen energías más bajas de las que poseen como átomos individuales. Se libera una cantidad de energía, igual a la diferencia entre las energías de los átomos unidos y las energías de los átomos separados, generalmente como calor. Es decir, los átomos unidos tienen una energía menor que los átomos individuales. Cuando los átomos se combinan para hacer un compuesto, la energía siempre se emite, y el compuesto tiene una energía general más baja. Al hacer compuestos, los átomos actúan como una básquetbol en un tobogán de juegos; se mueven en la dirección de disminuir la energía.
Podemos revertir el proceso poniendo energía en una molécula, lo que hace que sus enlaces se rompan, separando la molécula en átomos individuales. Los enlaces entre ciertos elementos específicos suelen tener una energía característica, llamada energía de disociación del enlace, que se necesita para romper el vínculo. La misma cantidad de energía se liberó cuando los átomos hicieron el enlace químico en primer lugar. El término energía de disociación de enlaces se usa generalmente para describir la fuerza de las interacciones entre los átomos que forman enlaces covalentes. Un enlace C-C tiene una energía de enlace aproximada de 80 kcal/mol, mientras que un C=C tiene una energía de enlace de aproximadamente 145 kcal/mol. El enlace C=C es más fuerte que C-C (como se discutió en relación con la longitud del enlace en la Sección 4.4). Para los átomos en compuestos iónicos atraídos por cargas opuestas, se utiliza el término energía reticular. Por ahora, trataremos con enlaces covalentes en moléculas.
Aunque cada molécula tiene su propia energía de disociación de enlace característica, algunas generalizaciones son posibles. Por ejemplo, aunque el valor exacto de una energía de enlace C—H depende de la molécula en particular, todos los enlaces C—H tienen una energía de enlace de aproximadamente el mismo valor porque todos son enlaces C—H. Se necesitan aproximadamente 100 kcal de energía para romper 1 mol de enlaces C—H, por lo que hablamos de la energía de disociación de enlaces de un enlace C—H como aproximadamente 100 kcal/mol. En la tabla se\(\PageIndex{1}\) enumeran las energías aproximadas de disociación de enlaces de diversos enlaces covalentes.
| Bond | Energía de disociación de enlace (kcal/mol) |
|---|---|
| C—H | 100 |
| C—O | 86 |
| C=O | 190 |
| C—N | 70 |
| C—C | 85 |
| C=C | 145 |
| C=C | 200 |
| N—H | 93 |
| H—H | 105 |
| Br-Br | 46 |
| Cl—Cl | 58 |
| O—H | 110 |
| O=O | 119 |
| H—Br | 87 |
| H—Cl | 103 |
Cuando ocurre una reacción química, los átomos en los reactivos reordenan sus enlaces químicos para hacer productos. La nueva disposición de los enlaces no tiene la misma energía total que los enlaces en los reactivos. Por lo tanto, cuando ocurren reacciones químicas, siempre habrá un cambio energético acompañante. El cambio de energía, para una reacción dada se puede calcular usando los valores de energía de disociación de enlace de la Tabla\(\PageIndex{1}\).
Cambio de entalpía o calor de reacción, Δ H
Durante una reacción química, los enlaces se rompen y se forman nuevos enlaces. Romper enlaces químicos es endotérmico, un proceso que requiere un aporte de energía o absorción de calor. El proceso inverso de ruptura del enlace es la formación de enlaces, que es exotérmica, lo que significa que libera energía o emite calor. Los valores de energía de disociación de enlaces enumerados en la tabla anterior dan la cantidad de energía requerida para romper un enlace específico. Cuando se reforma ese mismo enlace, se libera una cantidad idéntica de energía. El valor numérico de la energía es el mismo para romper y formar un vínculo, pero el signo, o dirección del proceso es diferente. El cambio energético global de una ruptura y reforma de un vínculo específico sería cero, es decir, la energía no se crea ni se destruye, siguiendo la ley de conservación de la energía.
En una reacción química, los enlaces que se rompen suelen ser diferentes a los enlaces que se reforman, a veces hay más calor absorbido (se rompen más enlaces) y a veces se libera más calor (se forman más enlaces). La diferencia medida entre el calor total absorbido y el calor total liberado durante una reacción química (realizada a presión constante) se denomina calor de reacción o cambio de entalpía, y se representa con el símbolo Δ H (donde el Δ representa cambio y la H representa entalpía).
\[\text{enthalpy change} ≈ \Sigma\ (\text{bond dissociation energies}_{reactants}) - \Sigma\ (\text{bond dissociation energies}_{products})\]
El signo ≈ se usa porque estamos sumando energías promedio de disociación de enlace; de ahí que este enfoque no da valores exactos para el cambio de entalpía, Δ H.
Consideremos la reacción de 2 moles de gas hidrógeno (H 2) con 1 mol de gas oxígeno (O 2) para dar 2 mol de agua:
\[2H_2(g)+O_2(g) \rightarrow 2H_2O(g)\]

H—H = 105 kcal/mol O=O = 119 kcal/mol O—H = 110 kcal/mol
En esta reacción, se rompen 2 enlaces H—H y 1 enlaces O=O del lado reactivo, mientras que se forman 4 enlaces O-H (dos por cada H 2 O) en el lado del producto. Los cambios de energía pueden ser tabulados y calculados de la siguiente manera:
| Energía de disociación del enlace reactivo (kcal/mol) | Energía de disociación del enlace del producto (kcal/mol) | ||
| 2 H—H | 2 mol x 105 kcal/mol = 210 kcal | 4 O—H | 4 moles x 110 kcal/mol = 440 kcal |
| 1 O=O | 1 mol x 119 kcal/mol = 119 kcal | ||
| Total = 329 kcal | Total = 440 kcal | ||
\[\: \: \: \: \: \Delta H ≈ \Sigma\ (\text{bond dissociation energies}_{reactants}) - \Sigma\ (\text{bond dissociation energies}_{products})\]
\[\: \: \: \: \: \Delta H ≈ 329 \: \text{kcal} - 440 \: \text{kcal}\]
\[\: \: \: \: \: \Delta H ≈ −111 \: \text{kcal}\]
El cambio de entalpía (ΔH) de la reacción es aproximadamente −111 kcal/mol. Esto significa que los enlaces en los productos (440 kcal) son más fuertes que los enlaces en los reactivos (329 kcal) en aproximadamente 111 kcal/mol. Debido a que los enlaces en los productos son más fuertes que los de los reactivos, la reacción libera más energía de la que absorbe. Este exceso de energía se libera como calor, por lo que la reacción es exotérmica. De ahí que podamos reescribir la reacción con el calor liberado (111 kcal) en el lado del producto de la ecuación, de la siguiente manera:
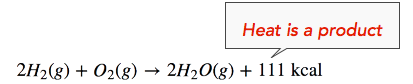
También podemos reescribir la ecuación de reacción con la información ΔH (ver más abajo). Tenga en cuenta que una reacción exotérmica tiene un valor ΔH negativo.
\[2H_2(g)+O_2(g) \rightarrow 2H_2O(g)\ \: \: \: \: \: \Delta H = -111 \: \text{kcal}\]
¿Cuál es el cambio de entalpía para esta reacción? ¿La reacción es exotérmica o endotérmica?
\[H_2(g)+Br_2(g) \rightarrow 2HBr(g)\]
Solución
Paso 1- Primero mire la ecuación e identifique qué enlaces existen en los reactivos (enlaces rotos).
- un enlace H-H y
- un enlace Br-Br
Paso 2- Hacer lo mismo con los productos (enlaces formados)
- dos bonos H-Br
Paso 3- Identificar las energías de disociación de enlaces de estos enlaces de la Tabla\(\PageIndex{1}\):
- Enlaces H-H: 105 kcal/mol
- Bonos Br-Br: 46 kcal/mol
Paso 4- Configura la tabla (ver abajo) y aplicar la fórmula para el cambio de entalpía.
| Energía de disociación del enlace reactivo (kcal/mol) | Energía de disociación del enlace del producto (kcal/mol) | ||
| 1 H—H | 1 mol x 105 kcal/mol = 105 kcal | 2 H— Br | 2 moles x 87 kcal/mol = 174 kcal |
| 1 Br—Br | 1 mol x 46 kcal/mol = 46 kcal | ||
| Total = 151 kcal | Total = 174 kcal | ||
|
\[\: \: \: \: \: \Delta H ≈ 151 \: \text{kcal} - 174 \: \text{kcal}\] \[\: \: \: \: \: \Delta H ≈ −23 \: \text{kcal}\] |
|||
Paso 5- Dado que Δ H es negativo (−23 kcal), la reacción es exotérmica.
Ejercicio\(\PageIndex{1}\)
Usando las energías de disociación de enlaces dadas en la tabla anterior, encuentre el cambio de entalpía para la descomposición térmica del agua:
\[H_2(g)+Cl_2(g) \rightarrow 2HCl(g)\]
¿La reacción escrita arriba es exotérmica o endotérmica? Explique.
- Contestar
-
Δ H = −43 kcal
Dado que Δ H es negativo (−43 kcal), la reacción es exotérmica.

