7.3: Reacciones exotérmicas y endotérmicas
- Page ID
- 72870
- Utilice energías de disociación de enlaces para calcular el cambio de entalpía o el calor de reacción.
- Determinar si un proceso químico es exotérmico o endotérmico.
Reacciones Endotérmicas y Exotérmicas
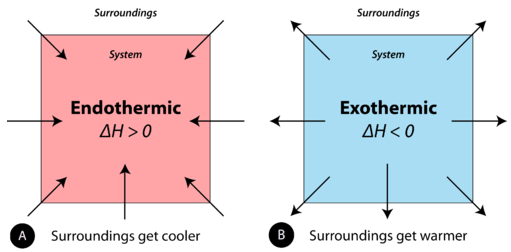
Se puede pensar que las reacciones endotérmicas y exotérmicas tienen energía como reactivo de la reacción o como producto. Las reacciones endotérmicas requieren energía, por lo que la energía es un reactivo. El calor fluye desde el entorno hacia el sistema (mezcla de reacción) y la entalpía del sistema aumenta (\(\Delta H\)es positiva). Como se discutió en la sección anterior, el calor es liberado (considerado un producto) en una reacción exotérmica, y la entalpía del sistema disminuye (\(\Delta H\)es negativa).
En el curso de un proceso endotérmico, el sistema gana calor del entorno y así la temperatura del entorno disminuye (se enfría). Una reacción química es exotérmica si el sistema libera calor al entorno. Debido a que el entorno está ganando calor del sistema, la temperatura de los alrededores aumenta. Ver Figura\(\PageIndex{1}\).
Reacción Endotérmica: Cuando\(1 \: \text{mol}\) de carbonato de calcio se descompone en\(1 \: \text{mol}\) de óxido de calcio y\(1 \: \text{mol}\) de dióxido de carbono,\(177.8 \: \text{kJ}\) de calor se absorbe. Debido a que el calor es absorbido por el sistema, el\(177.8 \: \text{kJ}\) se escribe como un reactivo. El\(\Delta H\) es positivo para una reacción endotérmica.

\[\ce{CaCO_3} \left( s \right) \rightarrow \ce{CaO} \left( s \right) + \ce{CO_2} \left( g \right) \: \: \: \: \: \Delta H = +177.8 \: \text{kJ}\]
Reacción exotérmica: Cuando se quema gas metano, se libera calor, haciendo que la reacción sea exotérmica. Específicamente, la combustión\(1 \: \text{mol}\) de metano libera 890.4 kilojulios de energía térmica. Esta información se puede mostrar como parte de la ecuación equilibrada de dos maneras. Primero, la cantidad de calor liberado se puede escribir en el lado del producto de la reacción. Otra forma es escribir la\(\Delta H\) información con un signo negativo,\(-890.4 \: \text{kJ}\).
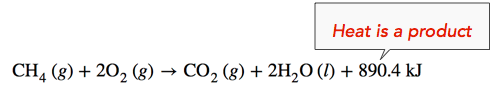
\[\ce{CH_4} \left( g \right) + 2 \ce{O_2} \left( g \right) \rightarrow \ce{CO_2} \left( g \right) + 2 \ce{H_2O} \left( l \right) \: \: \: \: \: \Delta H = -890.4 \: \text{kJ}\]
¿Cada reacción química es exotérmica o endotérmica?
- CH 4 (g) + 2O 2 (g) → CO 2 (g) + 2H 2 O (l) + 213 kcal
- N 2 (g) + O 2 (g) + 45 kcal → 2NO (g)
Solución
- Debido a que la energía (213 kcal) es un producto, la energía es desprendida por la reacción. Por lo tanto, esta reacción es exotérmica.
- Debido a que la energía (45 kcal) es un reactivo, la energía es absorbida por la reacción. Por lo tanto, esta reacción es endotérmica.
¿Cada reacción química es exotérmica o endotérmica?
- H 2 (g) + F 2 (g) → 2HF (g) + 130 kcal
- 2C (s) + H 2 (g) + 5.3 kcal → C 2 H 2 (g)
- Contestar
-
a. Se produce la energía (130 kcal), de ahí que la reacción sea exotérmica
b. La energía (5.3 kcal) es suministrada o absorbida para reaccionar, de ahí que la reacción sea endotérmica
Diagramas de Energía
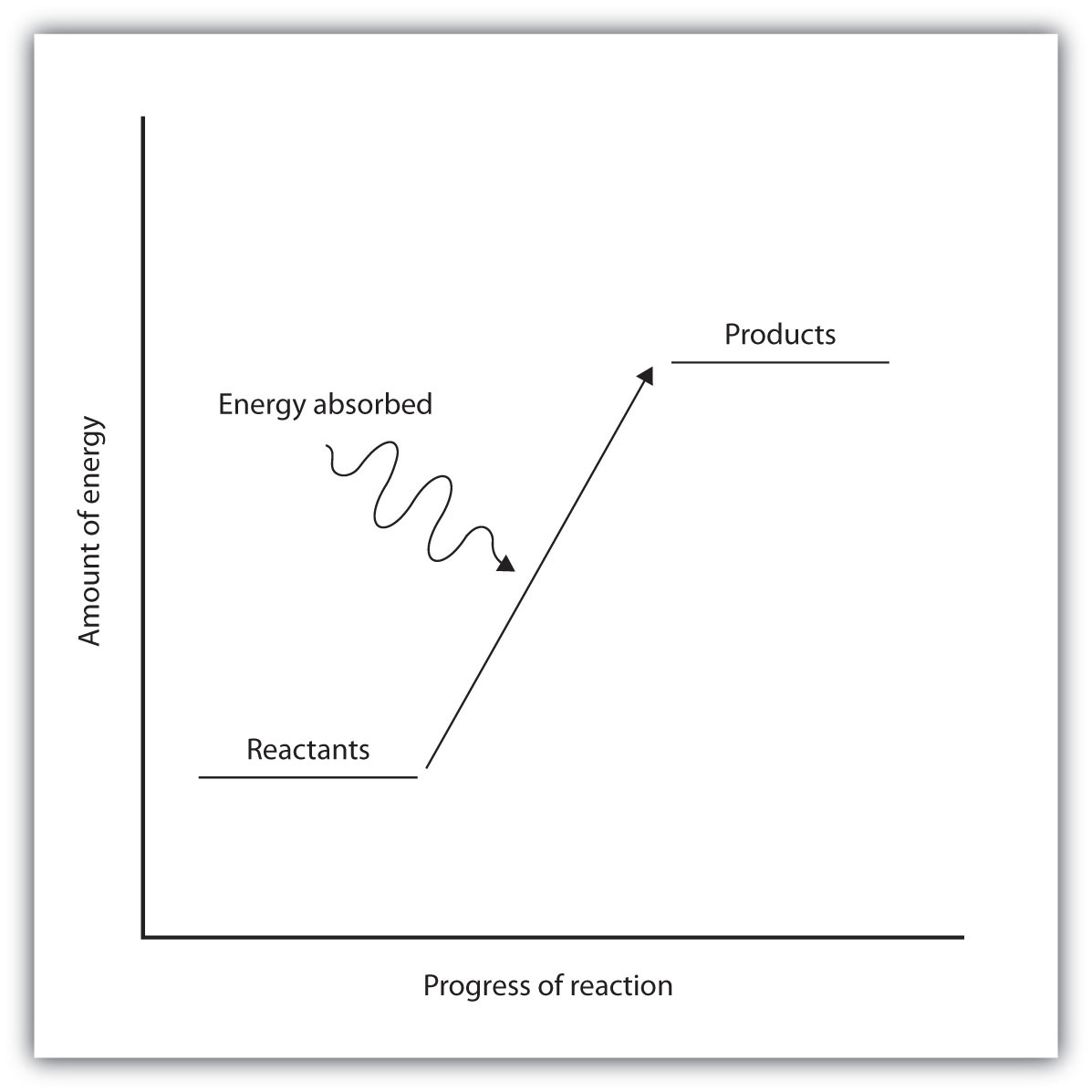
Las reacciones endotérmicas y exotérmicas se pueden representar visualmente mediante diagramas de nivel de energía como los de la Figura\(\PageIndex{2}\). En las reacciones endotérmicas, los reactivos tienen mayor energía de enlace (enlaces más fuertes) que los productos. Los enlaces fuertes tienen menor energía potencial que los enlaces débiles. De ahí que la energía de los reactivos sea menor que la de los productos. Este tipo de reacción está representada por un diagrama de nivel de energía “cuesta arriba” que se muestra en la Figura\(\PageIndex{2A}\). Para que se produzca una reacción química endotérmica, los reactivos deben absorber energía de su ambiente para convertirse en productos.
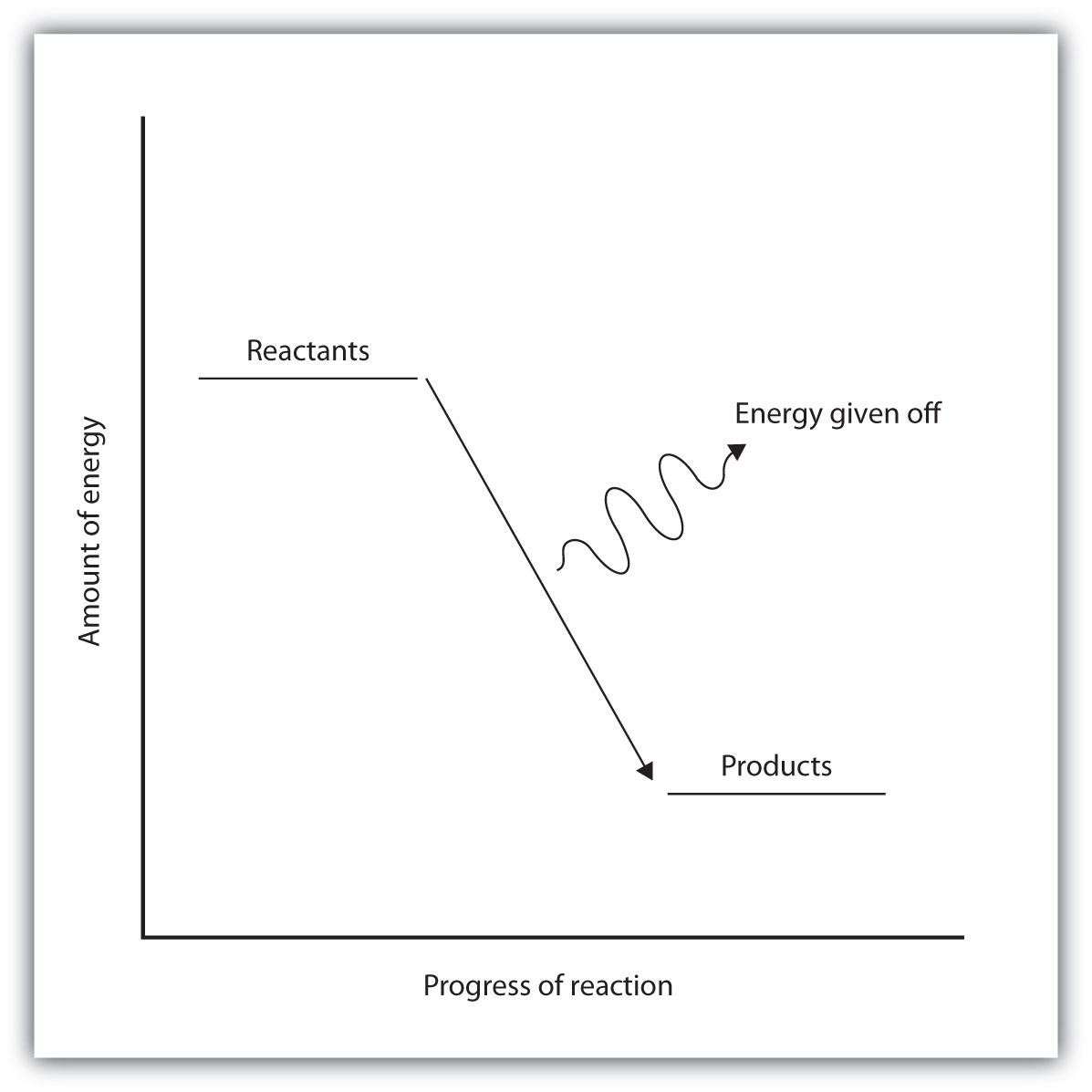
En una reacción exotérmica, los enlaces en el producto tienen mayor energía de enlace (enlaces más fuertes) que los reactivos. Es decir, la energía de los productos es menor que la energía de los reactivos, de ahí que sea energéticamente cuesta abajo, se muestra en la Figura\(\PageIndex{2B}\). La energía se emite a medida que los reactivos se convierten en productos. La energía desprendida suele ser en forma de calor (aunque algunas reacciones desprenden energía como luz). En el curso de una reacción exotérmica, el calor fluye del sistema a su entorno, y así, se calienta.
| Reacciones endotérmicas | Reacciones exotérmicas |
|---|---|
| El calor es absorbido por los reactivos para formar productos. | Se libera calor. |
| El calor se absorbe de los alrededores; como resultado, los alrededores se enfrían. | El calor es liberado por la reacción al entorno; los alrededores se sienten calientes. |
| \(\Delta H_{rxn}\)es positivo | \(\Delta H_{rxn}\)es negativo |
| Los enlaces rotos en los reactivos son más fuertes que los enlaces formados en los productos. | Los enlaces formados en los productos son más fuertes que los enlaces rotos en los reactivos. |
| Los reactivos son más bajos en energía que los productos. | Los productos son más bajos en energía que los reactivos. |
| Representado por un diagrama de energía “cuesta arriba”. | Representado por un diagrama de energía “cuesta abajo” |
Ejercicios de Revisión de Conceptos
- ¿Cuál es la conexión entre los enlaces energéticos y químicos?
- ¿Por qué cambia la energía durante el curso de una reacción química?
- Dos reacciones diferentes se realizan en dos tubos de ensayo idénticos. En la reacción A, el tubo de ensayo se vuelve muy caliente a medida que ocurre la reacción. En la reacción B, el tubo de ensayo se enfría. ¿Qué reacción es endotérmica y cuál es exotérmica? Explique.
- Clasificar el “papel quemado” como procesos endotérmicos o exotérmicos.
RESPUESTAS
- Los enlaces químicos tienen una cierta energía que depende de los elementos en el enlace y del número de enlaces entre los átomos.
- La energía cambia porque los enlaces se reordenan para hacer nuevos vínculos con diferentes energías.
- La reacción A es exotérmica porque el calor está saliendo del sistema haciendo que el tubo de ensayo se sienta caliente. La reacción B es endotérmica porque el calor está siendo absorbido por el sistema haciendo que el tubo de ensayo se sienta frío.
- “Quemar papel” es exotérmico porque la quema (también conocida como combustión) libera calor
Claves para llevar
- Los átomos se mantienen unidos por una cierta cantidad de energía llamada energía de enlace.
- Se requiere energía para romper los bonos. La energía se libera cuando se forman enlaces químicos porque los átomos se vuelven más estables.
- Los procesos químicos se etiquetan como exotérmicos o endotérmicos en función de si desprenden o absorben energía, respectivamente.

