8.1: Estados de la materia y sus cambios
- Page ID
- 73306
- Revisar los estados de la materia y sus propiedades
- Describir cómo el cambio de temperatura afectará el estado de la materia.
Anteriormente, se le presentaba a los tres estados, también llamados fases, de la materia; sólido, líquido y gas. Una fase es una cierta forma de materia que incluye un conjunto específico de propiedades físicas. Es decir, los átomos, las moléculas o los iones que componen la fase lo hacen de manera consistente a lo largo de la fase. La ciencia reconoce tres fases estables: la fase sólida, en la que las partículas individuales pueden ser consideradas como en contacto y mantenidas en su lugar; la fase líquida, en la que las partículas individuales están en contacto pero moviéndose unas con respecto a otras; y la fase gaseosa, en la que las partículas individuales están separadas entre sí por distancias relativamente grandes (ver Figura\(\PageIndex{1}\)).
El estado de una sustancia depende del equilibrio entre la energía cinética de las partículas individuales (moléculas o átomos) y las fuerzas atractivas entre moléculas, llamadas fuerzas intermoleculares. La energía cinética mantiene las moléculas separadas y moviéndose alrededor, y es una función de la temperatura de la sustancia. Las fuerzas intermoleculares juntan las partículas. Como se discutió anteriormente, los gases son muy sensibles a las temperaturas y la presión. Sin embargo, estos también afectan a líquidos y sólidos también. El calentamiento y el enfriamiento pueden cambiar la energía cinética de las partículas en una sustancia, y así, podemos cambiar el estado físico de una sustancia calentándola o enfriándola. El aumento de la presión sobre una sustancia fuerza a las moléculas más cercanas entre sí, lo que aumenta la fuerza de las fuerzas intermoleculares.
 |
 |
 |
| a) en estado gaseoso | b) como líquido | c) en forma sólida |
Aprovechamos los cambios entre los estados gaseoso, líquido y sólido para enfriar una bebida con cubitos de hielo (sólido a líquido), enfriar nuestro cuerpo por transpiración (líquido a gas) y enfriar alimentos dentro de un refrigerador (gas a líquido y viceversa). Utilizamos hielo seco, que es CO 2 sólido, como refrigerante (sólido a gas), y fabricamos nieve artificial para esquiar y hacer snowboard transformando un líquido en un sólido. En esta sección, examinamos lo que sucede cuando alguna de las tres formas de materia se convierte en alguna de las otras dos. Estos cambios de estado a menudo se denominan cambios de fase. Los seis cambios de fase más comunes se muestran en la Figura\(\PageIndex{2}\).
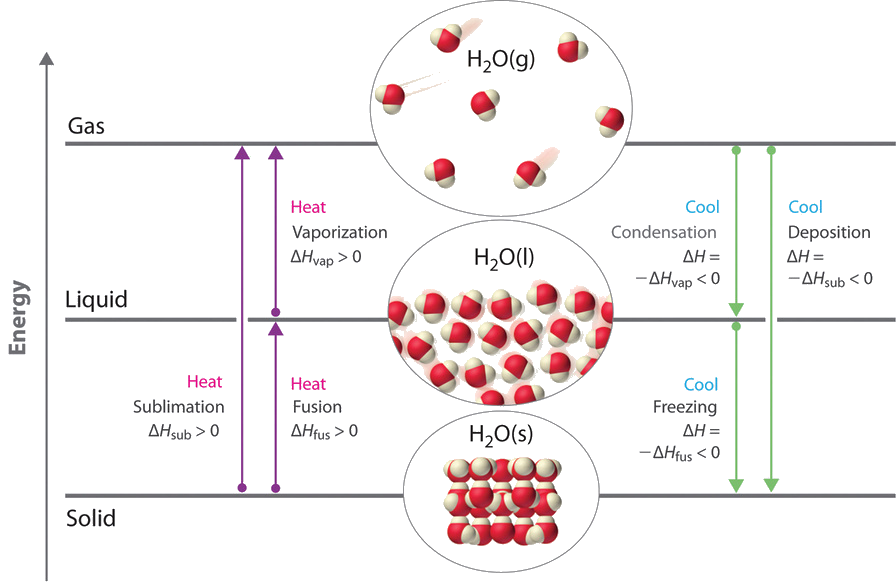
Cambios de energía que acompañan a los cambios de fase
Los cambios de fase siempre van acompañados de un cambio en la entalpía,\(\Delta H\), de un sistema. Por ejemplo, convertir un líquido, en el que las moléculas están muy juntas, en un gas, en el que las moléculas están, en promedio, muy separadas, requiere un aporte de energía (calor) para dar a las moléculas suficiente energía cinética para permitirles superar las fuerzas de atracción intermoleculares. Cuanto más fuertes sean las fuerzas atractivas, más energía se necesita para superarlas. Los sólidos, que son altamente ordenados, tienen las interacciones intermoleculares más fuertes, mientras que los gases, que están muy desordenados, tienen los más débiles. Así, cualquier transición de un estado más ordenado a uno menos ordenado (sólido a líquido, líquido a gas, o sólido a gas) requiere una entrada de energía; el\(\Delta H\) es positivo (endotérmico). Por el contrario, cualquier transición de un estado menos ordenado a uno más ordenado (líquido a sólido, gas a líquido o gas a sólido) libera energía; el\(\Delta H\) es negativo (exotérmico). El cambio de energía asociado con cada cambio de fase común se muestra en la Figura\(\PageIndex{2}\).
\(\Delta H\)es positivo para cualquier transición de un estado más ordenado a uno menos ordenado y negativo para una transición de un estado menos ordenado a uno más ordenado.
Anteriormente, definimos los cambios de entalpía asociados a diversos procesos químicos y físicos. Los puntos de fusión y entalpías molares de fusión (\(ΔH_{fus}\)), la energía requerida para convertir de un sólido a un líquido, un proceso conocido como fusión (o fusión), así como los puntos de ebullición normales y entalpías de vaporización (\(ΔH_{vap}\)) de compuestos seleccionados se listan en la Tabla\(\PageIndex{1}\).
| Sustancia | Punto de fusión (°C) | ΔH fus (kJ/mol) | Punto de ebullición (°C) | ΔH vap (kJ/mol) |
|---|---|---|---|---|
| N 2 | −210.0 | 0.71 | −195.8 | 5.6 |
| HCl | −114.2 | 2.00 | −85.1 | 16.2 |
| Br 2 | −7.2 | 10.6 | 58.8 | 30.0 |
| CCl 4 | −22.6 | 2.56 | 76.8 | 29.8 |
| CH 3 CH 2 OH (etanol) | −114.1 | 4.93 | 78.3 | 38.6 |
| CH 3 (CH 2) 4 CH 3 (n-hexano) | −95.4 | 13.1 | 68.7 | 28.9 |
| H 2 O | 0 | 6.01 | 100 | 40.7 |
| Na | 97.8 | 2.6 | 883 | 97.4 |
| NaF | 996 | 33.4 | 1704 | 176.1 |
Las sustancias con los puntos de fusión más altos suelen tener las entalpías de fusión más altas; tienden a ser compuestos iónicos que se mantienen unidos por interacciones electrostáticas muy fuertes. Las sustancias con altos puntos de ebullición son aquellas con fuertes interacciones intermoleculares que deben superarse para convertir un líquido en un gas, dando como resultado altas entalpías de vaporización. La entalpía de vaporización de una sustancia dada es mucho mayor que su entalpía de fusión porque se necesita más energía para separar completamente las moléculas (conversión de un líquido a un gas) que para permitirles que solo se muevan unas tras otras libremente (conversión de un sólido a un líquido).

