8.2: Fuerzas intermoleculares
- Page ID
- 73319
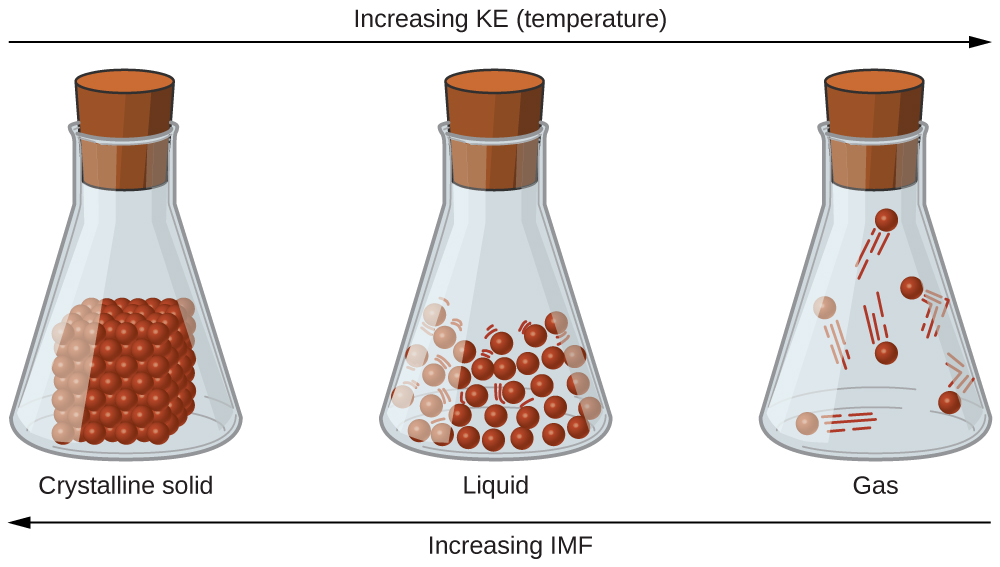
¿Qué explica esta variabilidad? ¿Por qué algunas sustancias se convierten en líquidos a temperaturas muy bajas, mientras que otras requieren temperaturas muy altas antes de convertirse en líquidos? Todo depende de la fuerza de las fuerzas intermoleculares (IMF) entre las partículas de sustancias y las energías cinéticas (KE) de sus moléculas. (Aunque los compuestos iónicos no están compuestos por moléculas discretas, todavía usaremos el término intermolecular para incluir interacciones entre los iones en dichos compuestos). Las sustancias que experimentan fuertes interacciones intermoleculares requieren temperaturas más altas para convertirse en líquidos y, finalmente, gases. Las sustancias que experimentan interacciones intermoleculares débiles no necesitan mucha energía (medida por la temperatura) para convertirse en líquidos y gases y exhibirán estas fases a temperaturas más bajas.
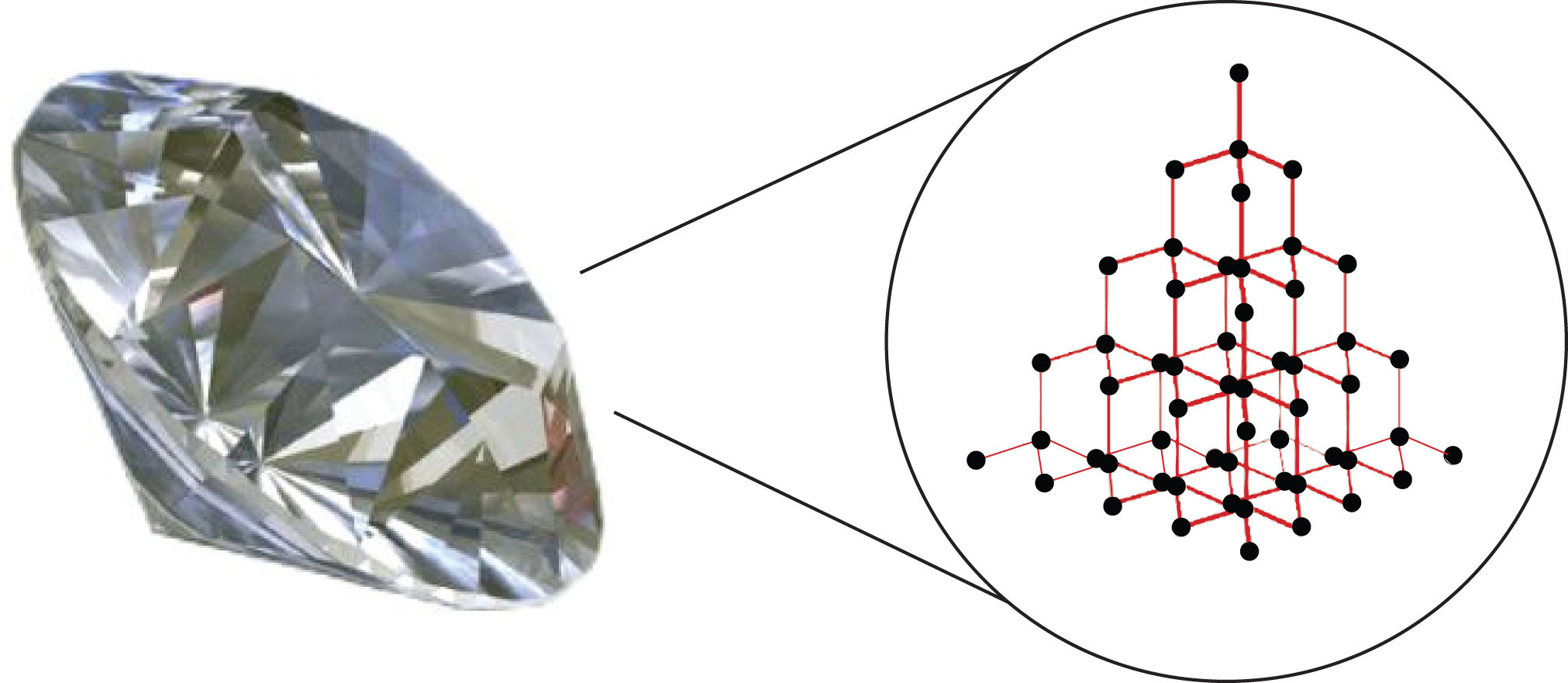
Materiales de red covalente
Las sustancias con los puntos de fusión y ebullición más altos tienen enlace de red covalente. Este tipo de interacción intermolecular es en realidad un enlace covalente. En estas sustancias, todos los átomos de una muestra están unidos covalentemente entre sí; en efecto, toda la muestra es esencialmente una molécula gigante. Muchas de estas sustancias son sólidas en un amplio rango de temperatura porque se necesita mucha energía para romper todos los enlaces covalentes a la vez. Un ejemplo de una sustancia que muestra enlaces covalentes de red es el diamante (Figura\(\PageIndex{2}\)). El diamante está compuesto completamente por átomos de carbono, cada uno unido a otros cuatro átomos de carbono en una geometría tetraédrica. La fusión de un sólido de red covalente no se logra superando las fuerzas intermoleculares relativamente débiles. Más bien, todos los enlaces covalentes deben romperse, proceso que requiere temperaturas extremadamente altas. El diamante, de hecho, no se derrite en absoluto. En cambio, se vaporiza a gas a temperaturas superiores a 3,500°C. El diamante es extremadamente duro y es uno de los pocos materiales que pueden cortar vidrio.
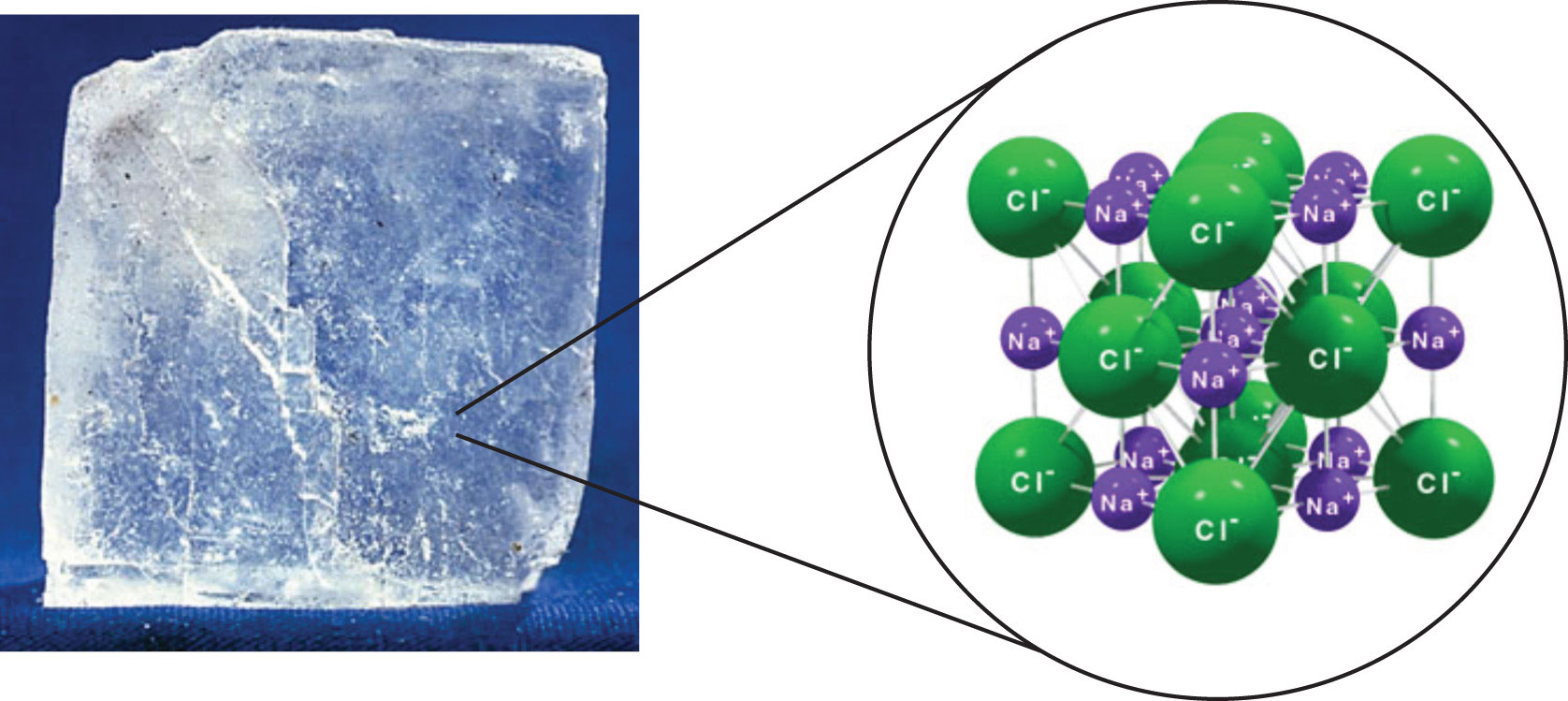
Compuestos Ionicos
La fuerza más fuerte entre dos partículas cualesquiera es el enlace iónico, en el que dos iones de carga opuesta son atraídos entre sí. Así, las interacciones iónicas entre partículas son otro tipo de interacción intermolecular. Las sustancias que contienen interacciones iónicas se mantienen unidas de manera relativamente fuerte, por lo que estas sustancias suelen tener altos puntos de fusión y ebullición. El cloruro de sodio (Figura\(\PageIndex{3}\)) es un ejemplo de una sustancia cuyas partículas experimentan interacciones iónicas (Tabla\(\PageIndex{1}\)). Estas fuerzas atractivas a veces se denominan interacciones ion-ion.
Compuestos moleculares covalentes
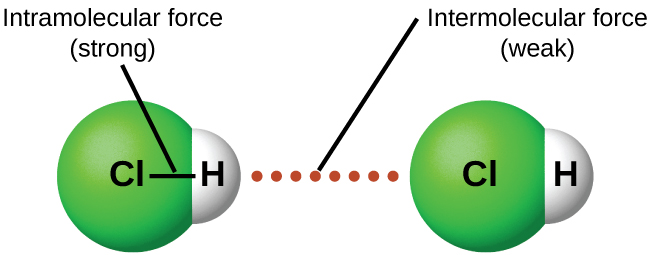
Existen dos estructuras covalentes diferentes: molecular y red. Los compuestos de red covalente como SiO 2 (cuarzo) tienen estructuras de átomos en una red como el diamante descrito anteriormente. En esta sección, se trata del tipo molecular que contiene moléculas individuales. El enlace entre los átomos en la molécula individual es covalente pero las fuerzas atractivas entre las moléculas se denominan fuerzas intermoleculares (IMF).
A diferencia de las fuerzas intramoleculares (ver Figura 8.1.4), como los enlaces covalentes que mantienen unidos a los átomos en moléculas e iones poliatómicos, las fuerzas intermoleculares mantienen unidas a las moléculas en un líquido o sólido. Las fuerzas intermoleculares son generalmente mucho más débiles que los enlaces covalentes. Por ejemplo, se requieren 927 kJ para superar las fuerzas intramoleculares y romper ambos enlaces O—H en 1 mol de agua, pero solo se necesitan alrededor de 41 kJ para superar las atracciones intermoleculares y convertir 1 mol de agua líquida en vapor de agua a 100°C. (A pesar de este valor aparentemente bajo, las fuerzas intermoleculares en ¡el agua líquida se encuentran entre las fuerzas más fuertes conocidas!) Dada la gran diferencia en las resistencias de las fuerzas intra e intermoleculares, los cambios entre los estados sólido, líquido y gaseoso ocurren casi invariablemente para sustancias moleculares sin romper los enlaces covalentes.
En esta sección, discutiremos los tres tipos de IMF en compuestos moleculares: dipolo-dipolo, enlaces de hidrógeno y fuerzas de dispersión de Londres.
Fuerzas intermoleculares dipolo-dipolo
Como se discute en la Sección 4.4, el enlace covalente que tiene una distribución desigual de electrones se denomina enlace covalente polar. (Un enlace covalente que tiene una distribución igual de electrones, como en un enlace covalente con el mismo átomo en cada lado, se llama enlace covalente no polar). Una molécula con una distribución neta desigual de electrones en sus enlaces covalentes es una molécula polar. La HF es un ejemplo de una molécula polar (ver Figura 8.1.5).
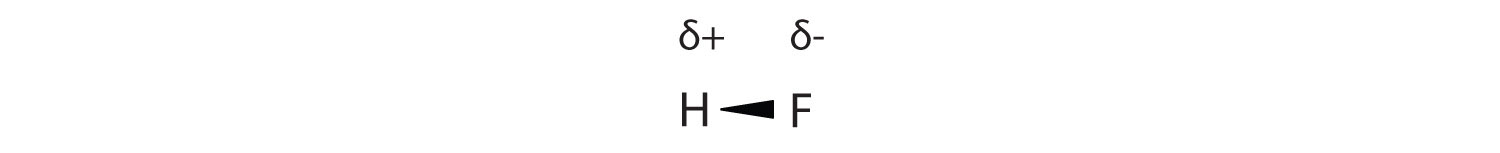
La separación de carga en un enlace covalente polar no es tan extrema como la que se encuentra en los compuestos iónicos, pero hay un resultado relacionado: los extremos con carga opuesta de diferentes moléculas se atraerán entre sí. Este tipo de interacción intermolecular se denomina interacción dipolo-dipolo. Muchas moléculas con enlaces covalentes polares experimentan interacciones dipolo-dipolo.
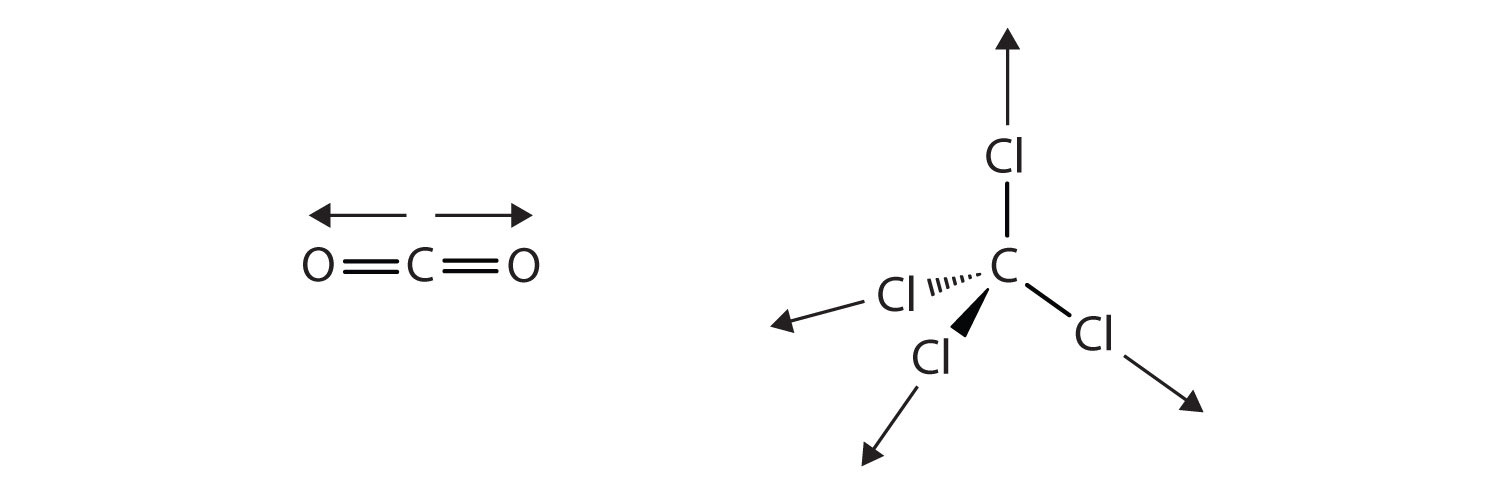
Los enlaces covalentes en algunas moléculas están orientados en el espacio de tal manera que los enlaces en las moléculas se cancelan entre sí. Los enlaces individuales son polares, pero debido a la simetría molecular, la molécula general no es polar; más bien, la molécula es no polar. Tales moléculas experimentan poca o ninguna interacción dipolo-dipolo. El dióxido de carbono (CO 2) y el tetracloruro de carbono (CCl 4) son ejemplos de tales moléculas (Figura\(\PageIndex{6}\)).
Recordemos de las Secciones 4.4 y 4.5, sobre la unión química y la geometría molecular que las moléculas polares tienen una carga positiva parcial en un lado y una carga negativa parcial en el otro lado de la molécula, una separación de carga llamada dipolo. Considera una molécula polar como cloruro de hidrógeno, HCl. En la molécula de HCl, el átomo de Cl más electronegativo lleva la carga negativa parcial, mientras que el átomo de H menos electronegativo lleva la carga positiva parcial. Una fuerza atractiva entre las moléculas de HCl resulta de la atracción entre el extremo positivo de una molécula de HCl y el extremo negativo de otra. Esta fuerza de atracción se denomina atracción dipolo-dipolo, la fuerza electrostática entre el extremo parcialmente positivo de una molécula polar y el extremo parcialmente negativo de otra, como se ilustra en la Figura\(\PageIndex{7}\).
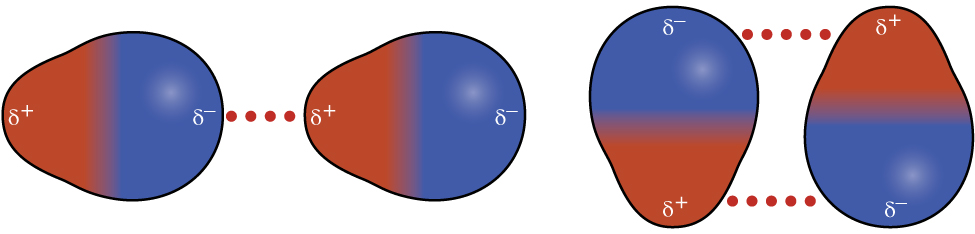
El efecto de una atracción dipolo-dipolo es evidente cuando comparamos las propiedades de las moléculas de HCl con las moléculas F 2 no polares. Tanto el HCl como el F 2 constan del mismo número de átomos y tienen aproximadamente la misma masa molecular. A una temperatura de 150 K, las moléculas de ambas sustancias tendrían la misma energía cinética promedio. Sin embargo, las atracciones dipolo-dipolo entre las moléculas de HCl son suficientes para hacer que se “peguen” para formar un líquido, mientras que las fuerzas de dispersión relativamente más débiles entre las moléculas F 2 no polares no lo son, por lo que esta sustancia es gaseosa a esta temperatura. El punto de ebullición normal más alto del HCl (188 K) en comparación con F 2 (85 K) es un reflejo de la mayor fuerza de atracciones dipolo-dipolo entre las moléculas de HCl, en comparación con las atracciones entre las moléculas F 2 no polares. A menudo utilizaremos valores como puntos de ebullición o congelación como indicadores de las fuerzas relativas de IMF de atracción presentes dentro de diferentes sustancias.
Predecir cuál tendrá el punto de ebullición más alto: N 2 o CO. Explica tu razonamiento.
Solución
CO y N 2 son moléculas diatómicas con masas de aproximadamente 28 amu, por lo que experimentan fuerzas de dispersión similares en Londres. Debido a que el CO es una molécula polar, experimenta atracciones dipolo-dipolo. Debido a que N 2 es no polar, sus moléculas no pueden exhibir atracciones dipolo-dipolo. Las atracciones dipolo-dipolo entre las moléculas de CO son comparablemente más fuertes que las fuerzas de dispersión entre las moléculas de N 2 no polares, por lo que se espera que el CO tenga el punto de ebullición más alto.
Ejercicio\(\PageIndex{1}\)
Predecir cuál tendrá el punto de ebullición más alto:\(\ce{ICl}\) o\(\ce{Br2}\). Explica tu razonamiento.
- Contestar
-
iCL. ICl y Br 2 tienen masas similares (~160 amu) y por lo tanto experimentan fuerzas de dispersión similares en Londres. ICl es polar y por lo tanto también exhibe atracciones dipolo-dipolo; Br 2 es no polar y no lo hace. Las atracciones dipolo-dipolo relativamente más fuertes requieren más energía para superar, por lo que iCL tendrá el punto de ebullición más alto.
Fuerzas intermoleculares de enlace de hidrógeno
Las moléculas con átomos de hidrógeno unidos a átomos electronegativos como O, N y F tienden a exhibir interacciones intermoleculares inusualmente fuertes debido a un tipo particularmente fuerte de atracción dipolo-dipolo llamada enlace de hidrógeno. La gran diferencia en electronegatividad entre el átomo de H (2.1) y el átomo al que está unido (4.0 para un átomo de F, 3.5 para un átomo de O, o 3.0 para un átomo de N), combinada con el tamaño muy pequeño de un átomo de H y los tamaños relativamente pequeños de los átomos de F, O o N, conduce a una concentración altamente concentrada cargas parciales con estos átomos. Debido a que el átomo de hidrógeno no tiene electrones que no sean los del enlace covalente, su núcleo cargado positivamente está casi completamente expuesto, permitiendo fuertes atractivos a otros pares de electrones solitarios cercanos.
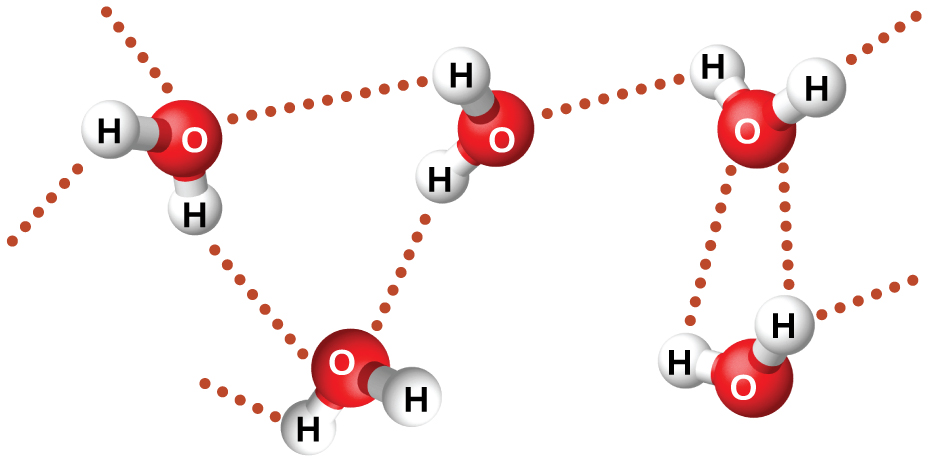
Ejemplos de enlaces de hidrógeno incluyen HFHF, H 2 OHOH y H 3 NHNH 2, en los que los enlaces de hidrógeno se denotan por puntos. La figura\(\PageIndex{8}\) ilustra enlaces de hidrógeno entre moléculas de agua. Las propiedades físicas del agua, que tiene dos enlaces O-H, se ven fuertemente afectadas por la presencia de enlaces de hidrógeno entre las moléculas de agua. La mayoría de los compuestos moleculares que tienen una masa similar al agua son gases a temperatura ambiente. Sin embargo, debido a los fuertes enlaces de hidrógeno, las moléculas de agua pueden permanecer condensadas en estado líquido.
Un enlace de hidrógeno es una fuerza de atracción intermolecular en la que un átomo de hidrógeno, que está unido covalentemente a un átomo pequeño y altamente electronegativo, es atraído por un par solitario de electrones en un átomo en una molécula vecina. La Figura\(\PageIndex{9}\) muestra cómo las moléculas de metanol (CH 3 OH) experimentan enlaces de hidrógeno. El metanol contiene tanto un átomo de hidrógeno unido a O; el metanol puede formar enlaces de hidrógeno actuando como donador de enlaces de hidrógeno o aceptor de enlaces de hidrógeno (par solitario). La estructura unida a hidrógeno del metanol es la siguiente:
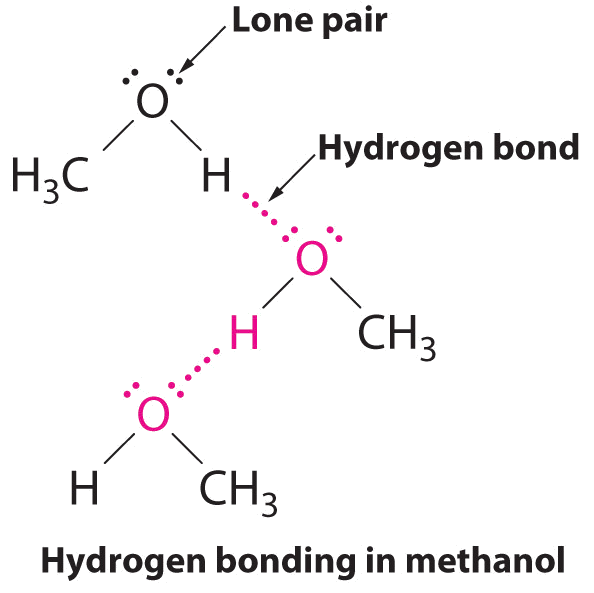
A pesar del uso de la palabra “enlace”, hay que tener en cuenta que los enlaces de hidrógeno son fuerzas de atracción intermoleculares, no fuerzas de atracción intramoleculares (enlaces covalentes). Los enlaces de hidrógeno son mucho más débiles que los enlaces covalentes, pero generalmente son mucho más fuertes que otras atracciones dipolo-dipolo y fuerzas de dispersión.
Considere los compuestos éter dimetílico (CH 3 OCH 3), etanol (CH 3 CH 2 OH) y propano (CH 3 CH 2 CH 3). Sus puntos de ebullición, no necesariamente en orden, son −42.1 °C, −24.8 °C y 78.4 °C. Coinciden cada compuesto con su punto de ebullición. Explica tu razonamiento.
Solución
Las formas de CH 3 OCH 3, CH 3 CH 2 OH y CH 3 CH 2 CH 3 son similares, al igual que sus masas molares (46 g/mol, 46 g/mol y 44 g/mol, respectivamente), por lo que exhibirán fuerzas de dispersión similares. Dado que CH 3 CH 2 CH 3 es no polar, puede exhibir solo fuerzas de dispersión. Debido a que CH 3 OCH 3 es polar, también experimentará atracciones dipolo-dipolo. Finalmente, CH 3 CH 2 OH tiene un grupo −OH, por lo que experimentará la atracción dipolo-dipolo excepcionalmente fuerte conocida como enlace de hidrógeno. Entonces el orden en términos de fuerza de IMF, y por lo tanto puntos de ebullición, es CH 3 CH 2 CH 3 < CH 3 OCH 3 < CH 3 CH 2 OH. El punto de ebullición del propano es −42.1 °C, el punto de ebullición del éter dimetílico es −24.8 °C y el punto de ebullición del etanol es 78.5 °C.
El etano (CH 3 CH 3) tiene un punto de fusión de −183 °C y un punto de ebullición de −89 °C. Predice los puntos de fusión y ebullición para la metilamina (CH 3 NH 2). Explica tu razonamiento.
- Contestar
-
Se prevé que el punto de fusión y el punto de ebullición de la metilamina sean significativamente mayores que los del etano. CH 3 CH 3 y CH 3 NH 2 son similares en tamaño y masa, pero la metilamina posee un grupo -NH y por lo tanto puede presentar enlaces de hidrógeno. Esto aumenta en gran medida sus IMF, y por lo tanto sus puntos de fusión y ebullición. Es difícil predecir valores, pero los valores conocidos son un punto de fusión de −93 °C y un punto de ebullición de −6 °C.
Enlace de hidrógeno y ADN
El ácido desoxirribonucleico (ADN) se encuentra en todos los organismos vivos y contiene la información genética que determina las características del organismo, proporciona el modelo para elaborar las proteínas necesarias para la vida y sirve como plantilla para transmitir esta información a la descendencia del organismo. Una molécula de ADN consiste en dos cadenas (anti-) paralelas de nucleótidos repetitivos, que forman su bien conocida estructura de doble hélice, como se muestra en la Figura\(\PageIndex{10}\).
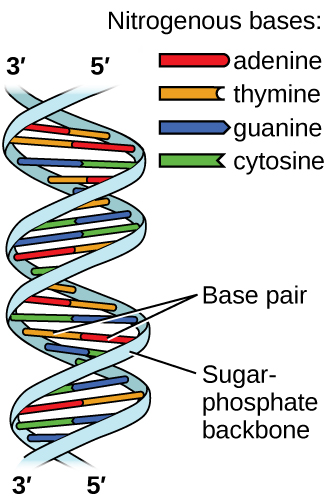
Cada nucleótido contiene un azúcar (desoxirribosa) unido a un grupo fosfato en un lado, y una de las cuatro bases nitrogenadas en el otro. Dos de las bases, citosina (C) y timina (T), son estructuras de un solo anillo conocidas como pirimidinas. Las otras dos, adenina (A) y guanina (G), son estructuras de doble anillo llamadas purinas. Estas bases forman pares de bases complementarias consistentes en una purina y una pirimidina, con apareamiento de adenina con timina, y citosina con guanina. Cada par de bases se mantiene unido por enlaces de hidrógeno. A y T comparten dos enlaces de hidrógeno, C y G comparten tres, y ambos emparejamientos tienen una forma y estructura similares Figura\(\PageIndex{11}\)
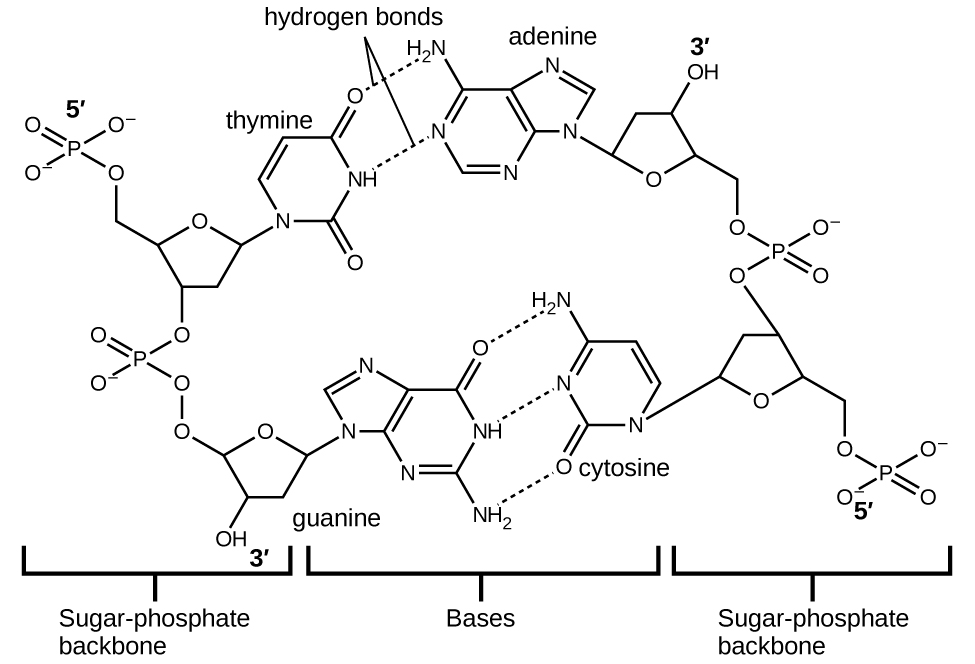
El efecto acumulativo de millones de enlaces de hidrógeno mantiene juntas las dos cadenas de ADN de manera efectiva. Es importante destacar que las dos cadenas de ADN pueden “descomprimir” con relativa facilidad por la mitad, ya que los enlaces de hidrógeno son relativamente débiles en comparación con los enlaces covalentes que mantienen unidos los átomos de las moléculas de ADN individuales. Esto permite que ambas cadenas funcionen como una plantilla para la replicación.
Fuerzas de dispersión de Londres
Por último, hay fuerzas entre todas las moléculas que son causadas por el hecho de que los electrones estén en diferentes lugares de una molécula en cualquier momento, lo que establece una separación temporal de carga que desaparece casi en cuanto aparece. Estas son interacciones intermoleculares muy débiles y se llaman fuerzas de dispersión (o fuerzas de Londres). (Un nombre alternativo es fuerzas de dispersión de Londres). Las moléculas que no experimentan otro tipo de interacción intermolecular experimentarán al menos fuerzas de dispersión. Las sustancias que solo experimentan fuerzas de dispersión son típicamente blandas en la fase sólida y tienen puntos de fusión relativamente bajos. Los ejemplos incluyen ceras, que son cadenas largas de hidrocarburos que son sólidos a temperatura ambiente debido a que las moléculas tienen tantos electrones. Las fuerzas de dispersión resultantes entre estas moléculas hacen que asuman la fase sólida a temperaturas normales.
Las fuerzas de dispersión que se desarrollan entre los átomos en diferentes moléculas pueden atraer a las dos moléculas entre sí. Las fuerzas son relativamente débiles, sin embargo, y se vuelven significativas solo cuando las moléculas están muy cerca. Los átomos y moléculas más grandes y más pesados exhiben fuerzas de dispersión más fuertes que los átomos y moléculas más pequeños y más ligeros. F 2 y Cl 2 son gases a temperatura ambiente (reflejando fuerzas de atracción más débiles); Br 2 es un líquido e I 2 es un sólido (reflejando fuerzas de atracción más fuertes). Las tendencias en los puntos de fusión y ebullición observados para los halógenos demuestran claramente este efecto, como se ve en la Tabla 8.1.2.
| Halógeno | Masa molar | Radio Atómico | Punto de fusión | Punto de ebullición |
|---|---|---|---|---|
| flúor, F 2 | 38 g/mol | 72 pm | 53 K | 85 K |
| cloro, Cl 2 | 71 g/mol | 99 pm | 172 K | 238 K |
| bromo, Br 2 | 160 g/mol | 114pm | 266 K | 332 K |
| yodo, I 2 | 254 g/mol | 133pm | 387 K | 457 K |
| astatino, At 2 | 420 g/mol | 150pm | 575 K | 610 K |
El aumento en los puntos de fusión y ebullición con el aumento del tamaño atómico/molecular puede racionalizarse considerando cómo la fuerza de las fuerzas de dispersión se ve afectada por la estructura electrónica de los átomos o moléculas en la sustancia. En un átomo mayor, los electrones de valencia están, en promedio, más alejados de los núcleos que en un átomo más pequeño. Así, se sujetan con menos fuerza y pueden formar más fácilmente los dipolos temporales que producen la atracción. La medida de lo fácil o difícil que es para otra carga electrostática (por ejemplo, un ion cercano o molécula polar) distorsionar la distribución de carga de una molécula (su nube de electrones) se conoce como polarizabilidad. Se dice que una molécula que tiene una nube de carga que se distorsiona fácilmente es muy polarizable y tendrá grandes fuerzas de dispersión; una con una nube de carga que es difícil de distorsionar no es muy polarizable y tendrá pequeñas fuerzas de dispersión.
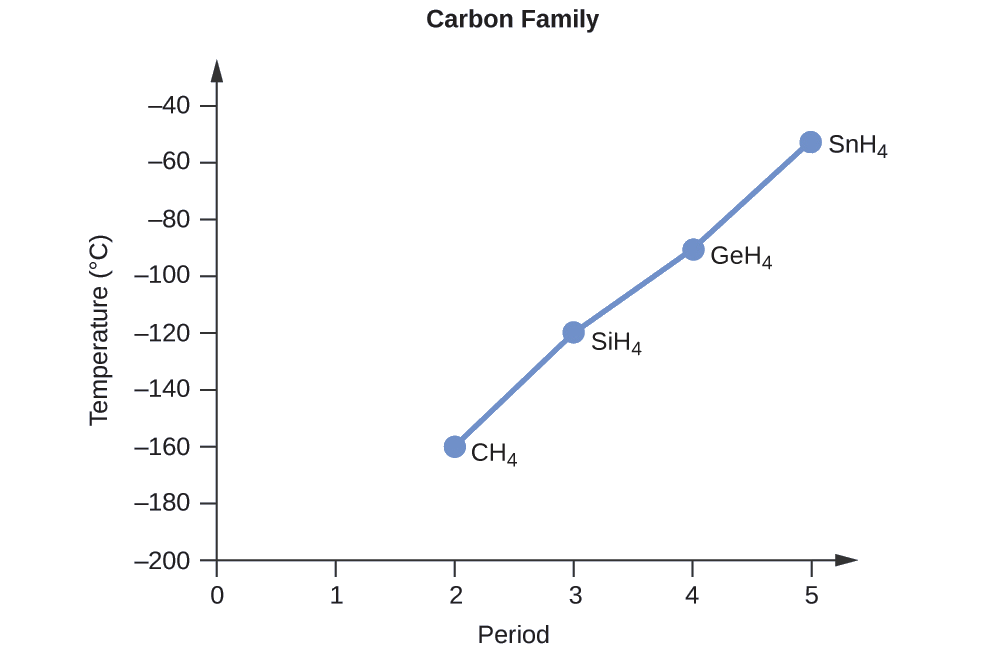
Ordene los siguientes compuestos de un elemento del grupo 14 e hidrógeno de menor a mayor punto de ebullición: CH 4, SiH 4, GeH 4 y SnH 4. Explica tu razonamiento.
Solución
Aplicando las habilidades adquiridas en el capítulo sobre unión química y geometría molecular, se predice que todos estos compuestos son no polares, por lo que pueden experimentar solo fuerzas de dispersión: cuanto más pequeña sea la molécula, menos polarizable y más débiles sean las fuerzas de dispersión; cuanto mayor sea la molécula, mayor será fuerzas de dispersión. Las masas molares de CH 4, SiH 4, GeH 4 y SnH 4 son aproximadamente 16 g/mol, 32 g/mol, 77 g/mol y 123 g/mol, respectivamente. Por lo tanto, se espera que CH 4 tenga el punto de ebullición más bajo y SnH 4 el punto de ebullición más alto. Se espera que el orden del punto de ebullición más bajo al más alto sea
CH 4 < SiH 4 < GeH 4 < SnH 4
Una gráfica de los puntos de ebullición reales de estos compuestos versus el periodo de los elementos del grupo 14 muestra que esta predicción es correcta:
Ejercicio\(\PageIndex{3}\)
Ordene los siguientes hidrocarburos de menor a mayor punto de ebullición: C 2 H 6, C 3 H 8 y C 4 H 10.
- Contestar
-
Todos estos compuestos son no polares y solo tienen fuerzas de dispersión de Londres: cuanto mayor es la molécula, mayores son las fuerzas de dispersión y mayor es el punto de ebullición. El orden del punto de ebullición más bajo al más alto es por lo tanto
C 2 H 6 < C 3 H 8 < C 4 H 10.
Los geckos tienen una increíble capacidad para adherirse a la mayoría de las superficies. Pueden correr rápidamente por paredes lisas y techos que no tienen soportes para los pies, y lo hacen sin tener ventosas o una sustancia pegajosa en los dedos de los pies. Y mientras un gecko puede levantar sus pies fácilmente mientras camina por una superficie, si intentas recogerlo, se pega a la superficie. ¿Cómo pueden hacer esto los geckos (así como las arañas y algunos otros insectos)? Si bien este fenómeno ha sido investigado durante cientos de años, los científicos solo recientemente descubrieron los detalles del proceso que permite que los pies de geckos se comporten de esta manera.

Los dedos de los pies de Geccos están cubiertos de cientos de miles de pelos diminutos conocidos como setas, con cada seta, a su vez, ramificándose en cientos de puntas diminutas, planas y triangulares llamadas espátulas. El enorme número de espatulas en sus setas proporcionan un gecko, que se muestra en la Figura 8.1.12, con una gran superficie total para adherirse a una superficie. En 2000, Kellar Autumn, quien lidera un equipo de investigación de gecko multi-institucional, encontró que los geckos se adhirieron igualmente bien tanto al dióxido de silicio polar como al arseniuro de galio no polar. Esto demostró que los geckos se adhieren a las superficies debido a las fuerzas de dispersión, débiles atracciones intermoleculares que surgen de distribuciones de carga temporales y sincronizadas entre moléculas adyacentes. Si bien las fuerzas de dispersión son muy débiles, la atracción total sobre millones de espáulas es lo suficientemente grande como para soportar muchas veces el peso del gecko.
En 2014, dos científicos desarrollaron un modelo para explicar cómo los geckos pueden pasar rápidamente de “pegajosos” a “no pegajosos”. Alex Greaney y Congcong Hu de la Universidad Estatal de Oregón describieron cómo los geckos pueden lograr esto cambiando el ángulo entre sus espáulas y la superficie. Los pies de Geckos, que normalmente no son pegajosos, se vuelven pegajosos cuando se aplica una pequeña fuerza de cizallamiento. Al rizar y desenroscar los dedos de los pies, los geckos pueden alternar entre pegarse y desprenderse de una superficie, y así moverse fácilmente a través de ella. Otras investigaciones pueden conducir eventualmente al desarrollo de mejores adhesivos y otras aplicaciones.
Puntos de ebullición y tipos de unión
Para que una sustancia entre en fase gaseosa, sus partículas deben superar completamente las fuerzas intermoleculares que las mantienen unidas. Por lo tanto, una comparación de puntos de ebullición es esencialmente equivalente a comparar las fuerzas de las atractivas fuerzas intermoleculares exhibidas por las moléculas individuales. Para los compuestos moleculares pequeños, las fuerzas de dispersión de Londres son las fuerzas intermoleculares más débiles. Las fuerzas dipolo-dipolo son algo más fuertes, y los enlaces de hidrógeno son una forma particularmente fuerte de interacción dipolo-dipolo. Sin embargo, cuando la masa de una molécula no polar es suficientemente grande, sus fuerzas de dispersión pueden ser más fuertes que las fuerzas dipolo-dipolo en una molécula polar más ligera. Así, el Cl 2 no polar tiene un punto de ebullición mayor que el HCl polar.
| Sustancia | Fuerza intermolecular más fuerte | Punto de ebullición\(\left( ^\text{o} \text{C} \right)\) |
|---|---|---|
| \(\ce{H_2}\) | dispersión | \ (\ left (^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; ">-253 |
| \(\ce{Ne}\) | dispersión | \ (\ left (^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; ">-246 |
| \(\ce{O_2}\) | dispersión | \ (\ left (^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; ">-183 |
| \(\ce{Cl_2}\) | dispersión | \ (\ left (^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; ">-34 |
| \(\ce{HCl}\) | dipolo-dipolo | \ (\ left (^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; ">-85 |
| \(\ce{HBr}\) | dipolo-dipolo | \ (\ left (^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; ">-66 |
| \(\ce{H_2S}\) | dipolo-dipolo | \ (\ left (^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; ">-61 |
| \(\ce{NH_3}\) | enlaces de hidrógeno | \ (\ left (^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; ">-33 |
| \(\ce{HF}\) | enlaces de hidrógeno | \ (\ left (^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; ">20 |
| \(\ce{H_2O}\) | enlaces de hidrógeno | \ (\ left (^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; ">100 |
¿Qué fuerzas intermoleculares además de las fuerzas de dispersión, si las hay, existen en cada sustancia? ¿Alguna de estas sustancias es sólida a temperatura ambiente?
- cloruro de potasio (KCl)
- etanol (C 2 H 5 OH)
- bromo (Br 2)
Solución
- El cloruro de potasio está compuesto por iones, por lo que la interacción intermolecular en el cloruro de potasio son las fuerzas iónicas. Debido a que las interacciones iónicas son fuertes, se podría esperar que el cloruro de potasio sea un sólido a temperatura ambiente.
- El etanol tiene un átomo de hidrógeno unido a un átomo de oxígeno, por lo que experimentaría enlaces de hidrógeno. Si el enlace de hidrógeno es lo suficientemente fuerte, el etanol podría ser un sólido a temperatura ambiente, pero es difícil saberlo con certeza. (El etanol es en realidad un líquido a temperatura ambiente.)
- El bromo elemental tiene dos átomos de bromo unidos covalentemente entre sí. Debido a que los átomos a cada lado del enlace covalente son los mismos, los electrones en el enlace covalente se comparten por igual, y el enlace es un enlace covalente no polar. Así, el bromo diatómico no tiene ninguna fuerza intermolecular que no sean fuerzas de dispersión. Es poco probable que sea un sólido a temperatura ambiente a menos que las fuerzas de dispersión sean lo suficientemente fuertes. El bromo es un líquido a temperatura ambiente.
¿Qué fuerzas intermoleculares además de las fuerzas de dispersión, si las hay, existen en cada sustancia? ¿Alguna de estas sustancias es sólida a temperatura ambiente?
- metilamina (CH 3 NH 2)
- sulfato de calcio (CaSO 4)
- monóxido de carbono (CO)
- Contestar
-
a. dipolo-dipolo, enlaces de hidrógeno
b. fuerzas iónicas (sólido a temperatura ambiente)
c. dipolo-dipolo
Ejercicio de revisión de conceptos
1. ¿Qué tipos de interacciones intermoleculares pueden existir en los compuestos?
2. ¿Cuál es la diferencia entre la red covalente y los compuestos moleculares covalentes?
Contestar
1. enlace iónico, covalente de red, fuerzas de dispersión, interacciones dipolo-dipolo y enlaces de hidrógeno.
2. Los compuestos de red covalente contienen átomos que están unidos covalentemente a otros átomos individuales en una red tridimensional gigante. Los compuestos moleculares covalentes contienen moléculas individuales que son atraídas entre sí a través de la dispersión, dipolo-dipolo o enlaces de hidrógeno.
Claves para llevar
- Una fase es una forma de materia que tiene las mismas propiedades físicas en todo momento.
- Las moléculas interactúan entre sí a través de varias fuerzas: interacciones dipolo-dipolo, enlaces de hidrógeno y fuerzas de dispersión.
- Las atracciones dipolo-dipolo resultan de la atracción electrostática del extremo negativo parcial de una molécula dipolar para el extremo positivo parcial de otra.
- Los enlaces de hidrógeno son un tipo especial de atracción dipolo-dipolo que resulta cuando el hidrógeno está unido a uno de los tres elementos más electronegativos: F, O o N.
- El dipolo temporal que resulta del movimiento de los electrones en un átomo puede inducir un dipolo en un átomo adyacente y dar lugar a la fuerza de dispersión de Londres. Las fuerzas de Londres aumentan con el aumento del tamaño molecular.
Ejercicios
-
Enumere las tres fases comunes en el orden en que probablemente las encuentre, desde la temperatura más baja hasta la temperatura más alta.
-
Enumere las tres fases comunes en el orden en que existen desde la energía más baja hasta la energía más alta.
-
Enumere estas interacciones intermoleculares de las más débiles a las más fuertes: fuerzas de Londres, enlaces de hidrógeno e interacciones iónicas.
-
Enumere estas interacciones intermoleculares de las más débiles a las más fuertes: enlace de red covalente, interacciones dipolo-dipolo y fuerzas de dispersión.
-
¿Qué tipo de interacción intermolecular predomina en cada sustancia?
- agua (H 2 O)
- sulfato de sodio (Na 2 SO 4)
- decano (C 10 H 22)
-
¿Qué tipo de interacción intermolecular predomina en cada sustancia?
- diamante (C, cristal)
- helio (He)
- amoníaco (NH 3)
-
Explicar cómo una molécula como el dióxido de carbono (CO 2) puede tener enlaces covalentes polares pero no polar en general.
-
El dióxido de azufre (SO 2) tiene una fórmula similar a la del dióxido de carbono (ver Ejercicio 7) pero es una molécula polar en general. ¿Qué se puede concluir sobre la forma de la molécula SO 2?
-
¿Cuáles son algunas de las propiedades físicas de las sustancias que experimentan enlaces covalentes a redes?
-
¿Cuáles son algunas de las propiedades físicas de las sustancias que solo experimentan fuerzas de dispersión?
RESPUESTAS
-
sólido, líquido y gas
-
Fuerzas de Londres, enlaces de hidrógeno e interacciones iónicas
-
- enlaces de hidrógeno
- interacciones iónicas
- fuerzas de dispersión
-
Los dos enlaces covalentes están orientados de tal manera que sus dipolos se cancelan.
9. muy duro, alto punto de fusión
10. muy suave, muy bajo punto de fusión

