12.8: Reacciones de alcanos
- Page ID
- 73429
- Comprender las reacciones de los alcanos: combustión y halogenación.
Los alcanos son moléculas no polares relativamente estables, que no reaccionan con ácidos, bases, ni reactivos oxidantes o reductores. Los alcanos experimentan tan pocas reacciones que a veces se les llama parafinas, del latín parum affinis, que significa “poca afinidad”.
Sin embargo, el calor o la luz pueden iniciar la ruptura de los enlaces simples C—H o C-C en reacciones llamadas combustión y halogenación.
Combustión
No pasa nada cuando los alcanos simplemente se mezclan con oxígeno (\(O_2\)) a temperatura ambiente, pero cuando una llama o chispa proporciona la energía de activación, se produce vigorosamente una reacción de combustión altamente exotérmica. Para el metano (CH 4), la reacción de combustión es la siguiente:
\[CH_4 + 2O_2 \rightarrow CO_2 + 2H_2O + \text{heat} \label{1} \]
Como consecuencia, los alcanos son excelentes combustibles. Por ejemplo, el metano, CH 4, es el principal componente del gas natural. El butano, C 4 H 10, utilizado en estufas y encendedores de camping es un alcano. La gasolina es una mezcla líquida de alcanos de cadena lineal y ramificada, cada uno de los cuales contiene de cinco a nueve átomos de carbono, además de diversos aditivos para mejorar su desempeño como combustible. El queroseno, el gasóleo y el fuel oil son principalmente mezclas de alcanos con masas moleculares más altas. La principal fuente de estos combustibles alcanos líquidos es el petróleo crudo, una mezcla compleja que se separa por destilación fraccionada. La destilación fraccionada aprovecha las diferencias en los puntos de ebullición de los componentes de la mezcla (Figura\(\PageIndex{1}\)). Se puede recordar que el punto de ebullición es una función de las interacciones intermoleculares, lo cual fue discutido en un capítulo anterior.
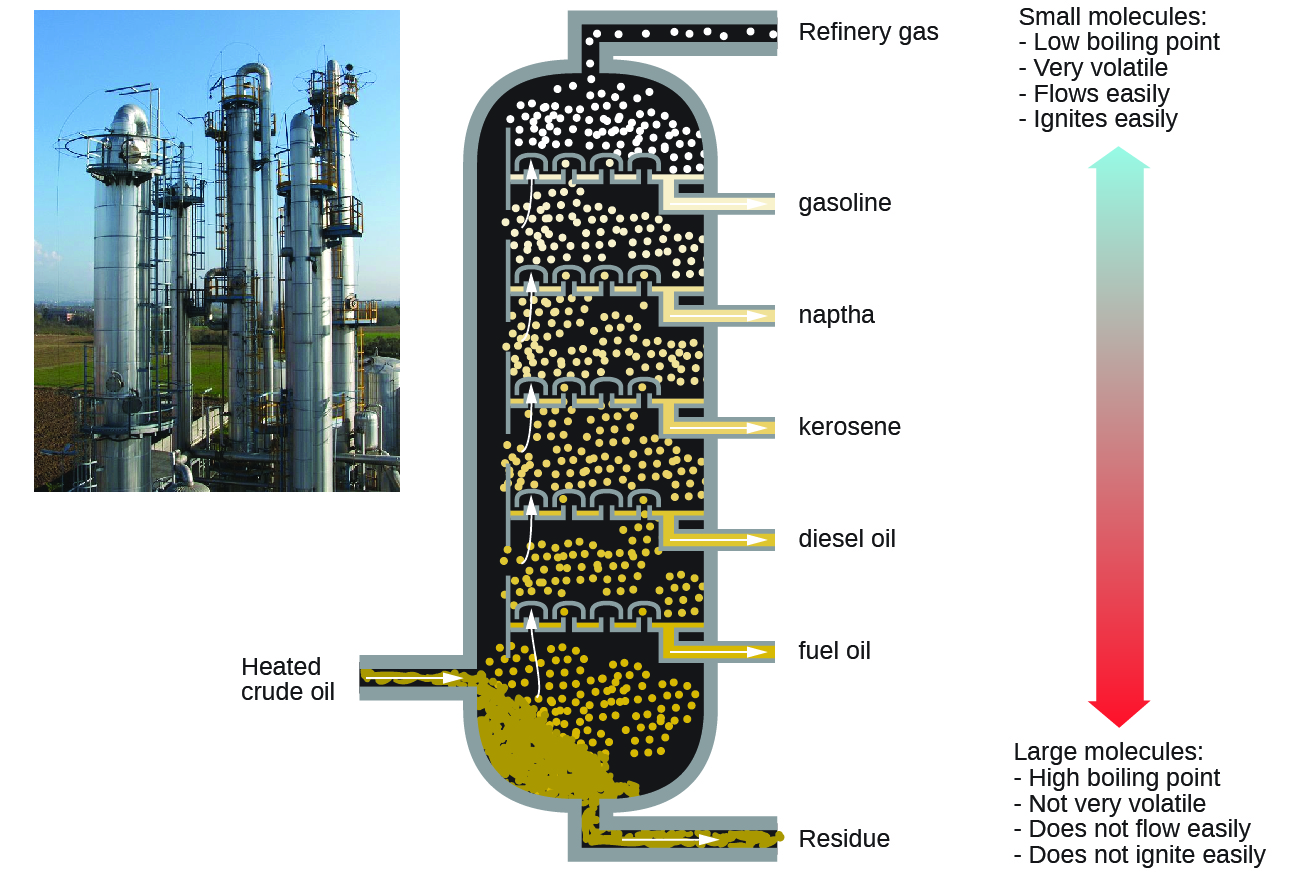
Si los reactivos de las reacciones de combustión se mezclan adecuadamente y hay suficiente oxígeno, los únicos productos son dióxido de carbono (\(CO_2\)), agua (\(H_2O\)) y energía: calor para cocinar alimentos, calentar hogares y secar ropa. Debido a que las condiciones rara vez son ideales, con frecuencia se forman otros subproductos no deseados. Cuando el suministro de oxígeno es limitado, el monóxido de carbono (\(CO\)) es un subproducto:
\[2CH_4 + 3O_2 \rightarrow 2CO + 4H_2O\label{2} \]
Esta reacción es responsable de decenas de muertes cada año por calentadores de gas sin ventilación o mal ajustados. (Reacciones similares con resultados similares ocurren con los calentadores de queroseno).
Halogenación
En las reacciones de halogenación, los alcanos reaccionan con los halógenos cloro (\(Cl_2\)\(Br_2\)) y bromo () en presencia de luz ultravioleta o a altas temperaturas para producir alcanos clorados y bromados. Por ejemplo, el cloro reacciona con el exceso de metano (\(CH_4\)) para dar cloruro de metilo (\(CH_3Cl\)).
\[CH_4 + Cl_2 \rightarrow CH_3Cl + HCl\label{12.7.3} \]
Con más cloro, se obtiene una mezcla de productos: CH 3 Cl, CH 2 Cl 2, CHCl 3 y CCl 4. El flúor (\(F_2\)), el halógeno más ligero, se combina explosivamente con la mayoría de los hidrocarburos. El yodo (\(I_2\)) es relativamente poco reactivo. Los alcanos fluorados y yodados se producen por métodos indirectos.
Una amplia variedad de compuestos interesantes y a menudo útiles tienen uno o más átomos de halógeno por molécula. Por ejemplo, el metano (CH 4) puede reaccionar con cloro (Cl 2), reemplazando uno, dos, tres o los cuatro átomos de hidrógeno con átomos de Cl. Varios productos halogenados derivados del metano y etano (CH 3 CH 3) se listan en la Tabla\(\PageIndex{1}\), junto con algunos de sus usos.
| Fórmula | Nombre común | Nombre de la IUPAC | Algunos usos importantes |
|---|---|---|---|
| Derivado de CH 4 | |||
| CH 3 Cl | cloruro de metilo | clorometano | refrigerante; la fabricación de siliconas, metilcelulosa y caucho sintético |
| CH 2 Cl 2 | cloruro de metileno | diclorometano | solvente de laboratorio e industrial |
| CHCl 3 | cloroformo | triclorometano | solvente industrial |
| CCl 4 | tetracloruro de carbono | tetraclorometano | Solvente de limpieza en seco y extintores de incendios (pero ya no se recomienda su uso) |
| CBrF 3 | halón-1301 | bromotrifluorometano | sistemas de extintores |
| CCl 3 F | clorofluorocarbono-11 (CFC-11) | triclorofluorometano | plásticos espumantes |
| CCl 2 F 2 | clorofluorocarbono-12 (CFC-12) | diclorodifluorometano | refrigerante |
| Derivado de CH 3 CH 3 | |||
| CH 3 CH 2 Cl | cloruro de etilo | cloroetano | anestésico local |
| CLch 2 CH 2 Cl | dicloruro de etileno | 1,2-dicloroetano | solvente para caucho |
| CCl 3 CH 3 | metilcloroformo | 1,1,1-tricloroetano | solvente para limpiar chips de computadora y moldes para dar forma a plásticos |
Una vez ampliamente utilizados en productos de consumo, muchos hidrocarburos clorados son sospechosos de carcinógenos (sustancias cancerígenas) y también se sabe que causan daño hepático severo. Un ejemplo es el tetracloruro de carbono (CCl 4), una vez utilizado como disolvente de limpieza en seco y en extintores pero ya no recomendado para ninguno de los dos usos. Incluso en pequeñas cantidades, su vapor puede causar enfermedades graves si la exposición es prolongada. Además, reacciona con el agua a altas temperaturas para formar gas mortal fosgeno (CoCl 2), lo que hace que el uso del CCl 4 en los extintores sea particularmente peligroso.
El cloruro de etilo, por el contrario, se utiliza como anestésico local externo. Cuando se pulveriza sobre la piel, se evapora rápidamente, enfriando la zona lo suficiente como para hacerla insensible al dolor. También se puede utilizar como anestésico general de emergencia.
Los compuestos que contienen bromo son ampliamente utilizados en extintores de incendios y como retardantes de fuego en prendas de vestir y otros materiales. Debido a que ellos también son tóxicos y tienen efectos adversos en el medio ambiente, los científicos se dedican a diseñar sustitutos más seguros para ellos, como para muchos otros compuestos halogenados.
Los alcanos sustituidos con átomos de flúor (F) y cloro (Cl) se han utilizado como gases dispersantes en latas de aerosol, como agentes espumantes para plásticos y como refrigerantes. Dos de los más conocidos de estos clorofluorocarbonos (CFC) se enumeran en la Tabla\(\PageIndex{2}\).
Los clorofluorocarbonos contribuyen al efecto invernadero en la atmósfera inferior. También se difunden en la estratosfera, donde se descomponen por la radiación ultravioleta (UV) para liberar átomos de Cl. Estos a su vez descomponen las moléculas de ozono (O 3) que protegen a la Tierra de la dañina radiación UV. La acción mundial ha reducido el uso de CFC y compuestos relacionados. Los CFC y otros compuestos destructores de ozono que contienen Cl o bromo (Br) están siendo reemplazados por sustancias más benignas. Los hidrofluorocarbonos (HFC), como CH 2 FCF 3, que no tienen Cl ni Br para formar radicales, son una alternativa. Otro son los hidroclorofluorocarbonos (HCFC), como el CHCl 2 CF 3. Las moléculas de HCFC se descomponen más fácilmente en la troposfera y menos moléculas destructoras de ozono llegan a la estratosfera.
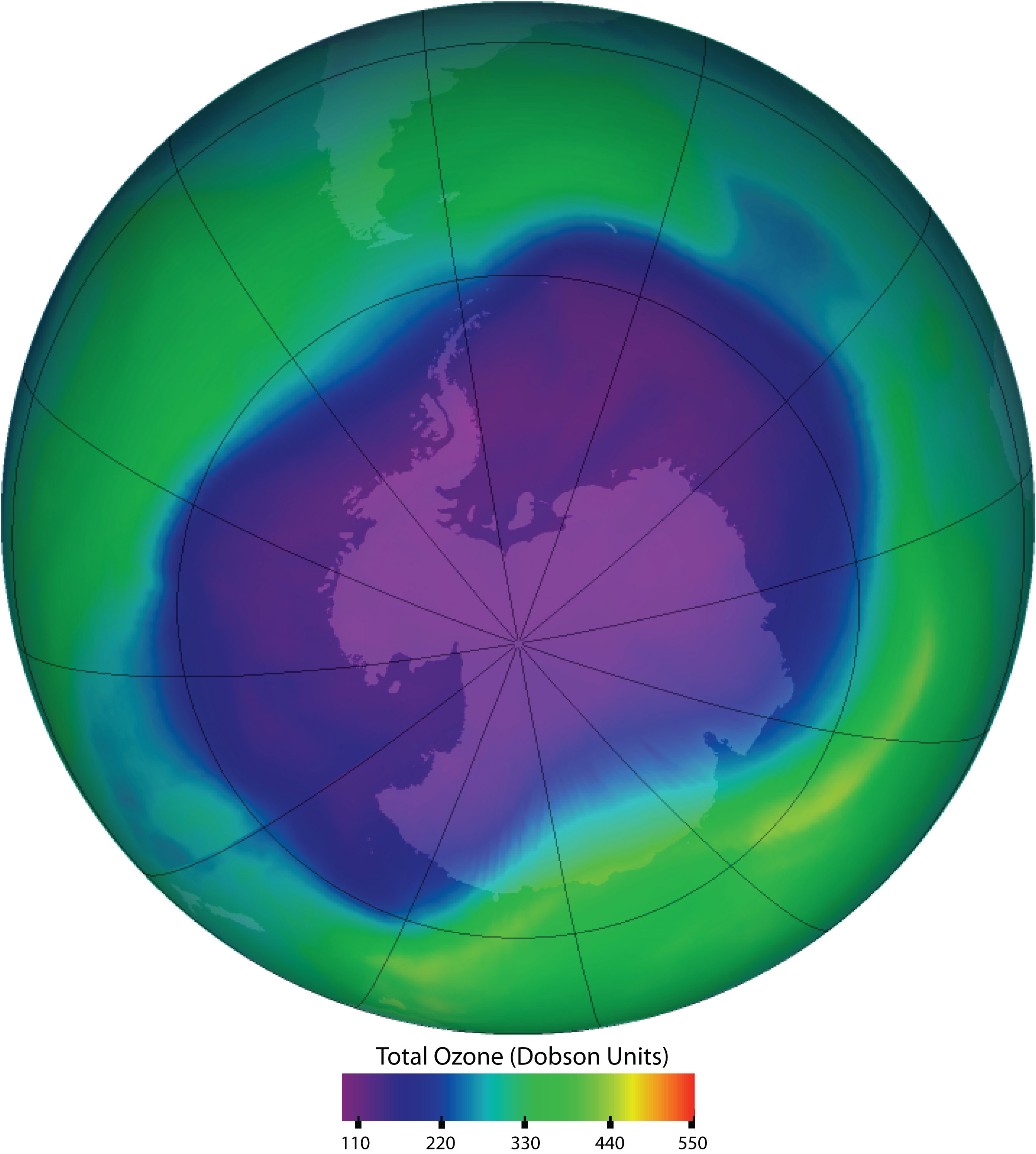
Figura\(\PageIndex{2}\): El ozono en la atmósfera superior protege la superficie de la Tierra de la radiación UV del sol, lo que puede causar cáncer de piel en humanos y también es perjudicial para otros animales y algunas plantas. Los “agujeros” de ozono en la atmósfera superior (las áreas gris, rosa y púrpura en el centro) son grandes áreas de agotamiento sustancial del ozono. Ocurren principalmente sobre la Antártida desde finales de agosto hasta principios de octubre y se llenan alrededor de mediados de noviembre. También se ha observado el agotamiento del ozono en las regiones árticas. El agujero de ozono más grande jamás observado ocurrió el 24 de septiembre de 2006. Fuente: Imagen cortesía de NASA, http://ozonewatch.gsfc.nasa.gov/daily.php?date=2006-09-24.

