16.3: Propiedades de las aminas
- Page ID
- 73050
- Explicar por qué los puntos de ebullición de las aminas primarias y secundarias son mayores que los de alcanos o éteres de masa molar similar pero son menores que los de los alcoholes.
- Comparar los puntos de ebullición de aminas terciarias con alcoholes, alcanos y éteres de masa molar similar.
- Comparar las solubilidades en agua de aminas de cinco o menos átomos de carbono con las solubilidades de alcanos y alcoholes comparables en agua.
Las aminas primarias y secundarias tienen átomos de hidrógeno unidos a un átomo de nitrógeno y, por lo tanto, son capaces de formar enlaces de hidrógeno (parte (a\(\PageIndex{1}\)) de la Figura), aunque no tan fuertemente como las moléculas de alcohol (que tienen átomos de hidrógeno unidos a un átomo de oxígeno, que es más electronegativo que el nitrógeno). Estas aminas hierven a temperaturas más altas que los alcanos pero a temperaturas más bajas que los alcoholes de masa molar comparable. Por ejemplo, compare el punto de ebullición de la metilamina (CH 3 NH 2; −6°C) con los de etano (CH 3 CH 3; −89°C) y metanol (CH 3 OH; 65°C). Las aminas terciarias no tienen átomo de hidrógeno unido al átomo de nitrógeno y, por lo tanto, no pueden participar en enlaces de hidrógeno intermoleculares. Tienen puntos de ebullición comparables a los de los éteres (Tabla\(\PageIndex{1}\)).

| Nombre | Fórmula estructural condensada | Clase | Masa molar | Punto de ebullición (°C) | Solubilidad a 25°C (g/100 g Agua) |
|---|---|---|---|---|---|
| butilamina | CH 3 CH 2 CH 2 CH 2 NH 2 | 1° | 73 | 78 | miscible |
| dietilamina | (CH 3 CH 2) 2 NH | 2° | 73 | 55 | miscible |
| alcohol butílico | CH 3 CH 2 CH 2 CH 2 OH | — | 74 | 118 | 8 |
| dipropilamina | (CH 3 CH 2 CH 2) 2 NH | 2° | 101 | 111 | 4 |
| trietilamina | (CH 3 CH 2) 3 N | 3° | 101 | 90 | 14 |
| dipropil éter | (CH 3 CH 2 CH 2) 2 O | — | 102 | 91 | 0.25 |
Las tres clases de aminas pueden participar en enlaces de hidrógeno con agua (Figura\(\PageIndex{1b}\)). Las aminas de baja masa molar son bastante solubles en agua; el límite de solubilidad en agua es de cinco o seis átomos de carbono.
Las aminas tienen olores “interesantes”. Los simples huelen mucho a amoníaco. Las aminas alifáticas superiores huelen a pescado en descomposición. O tal vez deberíamos ponerlo al revés: Los peces en descomposición desprenden aminas olorosas. El hedor del pescado podrido se debe en parte a dos diaminas: putrescina y cadaverina. Surgen de la descarboxilación de ornitina y lisina, respectivamente, aminoácidos que se encuentran en las células animales.
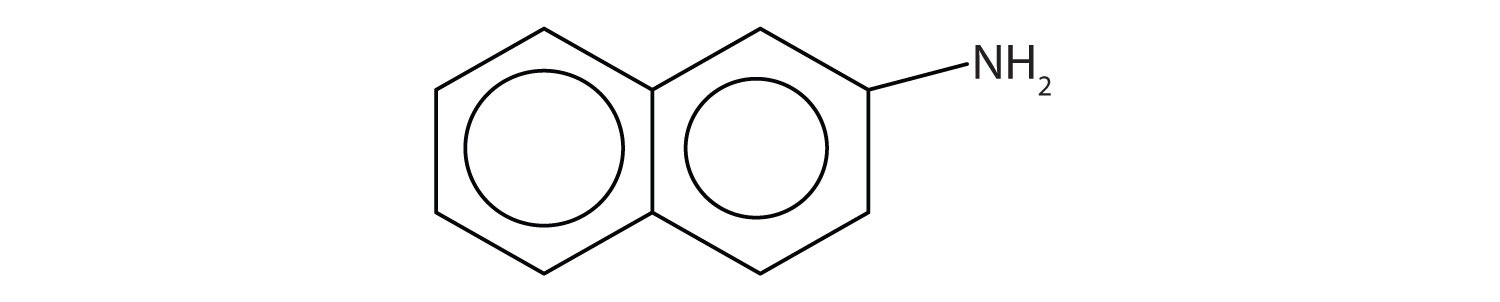
Las aminas aromáticas generalmente son bastante tóxicas. Se absorben fácilmente a través de la piel, y los trabajadores deben tener precaución al manipular estos compuestos. Varias aminas aromáticas, incluida la β-naftilamina, son potentes carcinógenos.
Claves para llevar
- Las aminas primarias y secundarias tienen puntos de ebullición más altos que los de alcanos o éteres de masa molar similar porque pueden participar en enlaces de hidrógeno intermoleculares. Sus puntos de ebullición son más bajos que los de los alcoholes porque las moléculas de alcohol tienen átomos de hidrógeno unidos a un átomo de oxígeno, que es más electronegativo.
- Los puntos de ebullición de las aminas terciarias, que no pueden enganchar enlaces de hidrógeno por no tener ningún átomo de hidrógeno en el átomo de nitrógeno, son comparables a los de alcanos y éteres de masa molar similar.
- Debido a que las tres clases de aminas pueden participar en enlaces de hidrógeno con agua, las aminas de baja masa molar son bastante solubles en agua.
Ejercicios de Revisión de Conceptos
-
¿Qué compuesto tiene el mayor punto de ebullición, CH 3 CH 2 CH 2 CH 2 CH 2 NH 2 o CH 3 CH 2 CH 2 CH 2 CH 2 CH 2 CH 3? Explique.
-
¿Qué compuesto es más soluble en agua, CH 3 CH 2 CH 2 CH 2 CH 3 o CH 3 CH 2 NHCH 2 CH 3? Explique.
RESPUESTAS
-
CH 3 CH 2 CH 2 CH 2 CH 2 NH 2 porque los enlaces nitrógeno a hidrógeno (N—H) pueden acoplarse en enlaces de hidrógeno; CH 3 CH 2 CH 2 CH 2 CH 2 CH 3 no puede enganchar en hidrógeno unión
-
CH 3 CH 2 NHCH 2 CH 3 porque las aminas pueden participar en enlaces de hidrógeno con agua; los alcanos no pueden participar en enlaces de hidrógeno
Ejercicios
-
¿Qué compuesto de cada par tiene el punto de ebullición más alto? Explique.
- butilamina o pentano
- CH 3 NH 2 o CH 3 CH 2 CH 2 CH 2 CH 2 NH 2
-
¿Qué compuesto de cada par tiene el punto de ebullición más alto? Explique.
- butilamina o alcohol butílico
- trimetilamina o propilamina
-
¿Qué compuesto es más soluble en agua—CH 3 CH 2 CH 3 o CH 3 CH 2 NH 2? Explique.
-
¿Qué compuesto es más soluble en agua—CH 3 CH 2 CH 2 NH 2 o CH 3 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 NH 2? Explique.
RESPUESTAS
-
- butilamina porque los enlaces N-H pueden participar en enlaces de hidrógeno; el pentano no puede participar en enlaces de hidrógeno
- CH 3 CH 2 CH 2 CH 2 CH 2 NH 2 porque tiene una masa molar mayor que CH 3 NH 2
-
CH 3 CH 2 NH 2 porque las aminas pueden participar en enlaces de hidrógeno con agua; los alcanos no pueden participar en enlaces de hidrógeno

