18.7: Estructura de Proteína Secundaria
- Page ID
- 73155
- Objetivo 1
- Objetivo 2
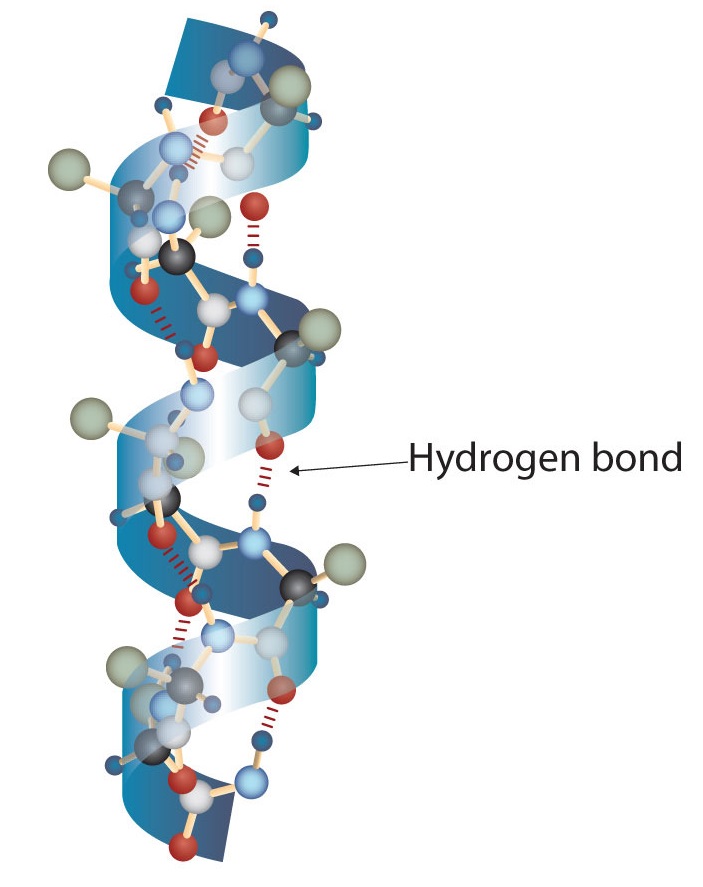
Una molécula de proteína no es una maraña aleatoria de cadenas polipeptídicas. En cambio, las cadenas están dispuestas en conformaciones únicas pero específicas. El término estructura secundaria se refiere a la disposición fija del esqueleto polipeptídico. A partir de estudios de rayos X, Linus Pauling y Robert Corey postularon que ciertas proteínas o porciones de proteínas se tuercen en espiral o hélice. Esta hélice se estabiliza mediante enlaces de hidrógeno intracatenarios entre el átomo de oxígeno carbonilo de un aminoácido y el átomo de hidrógeno de amida cuatro aminoácidos en la cadena (ubicado en el siguiente giro de la hélice) y se conoce como hélice α diestra. Los datos de rayos X indican que esta hélice hace un giro por cada 3.6 aminoácidos, y las cadenas laterales de estos aminoácidos se proyectan hacia afuera desde la cadena principal enrollada (Figura\(\PageIndex{1}\)). Las α-queratinas, que se encuentran en el pelo y la lana, son exclusivamente α-helicoidales en conformación. Algunas proteínas, como la gammaglobulina, la quimotripsina y el citocromo c, tienen poca o ninguna estructura helicoidal. Otras, como la hemoglobina y la mioglobina, son helicoidales en ciertas regiones pero no en otras.
Otro tipo común de estructura secundaria, llamada conformación de lámina plisada β, es una disposición laminar en la que dos o más cadenas polipeptídicas extendidas (o regiones separadas en la misma cadena) están alineadas una al lado de la otra. Los segmentos alineados pueden correr paralelos o antiparalelos, es decir, los terminales N pueden estar enfrentados en la misma dirección en cadenas adyacentes o en diferentes direcciones, y están conectados por enlaces de hidrógeno entre cadenas (Figura\(\PageIndex{3}\)). La lámina plisada β es particularmente importante en proteínas estructurales, como la fibroína de seda. También se observa en porciones de muchas enzimas, como la carboxipeptidasa A y la lisozima.


