18.8: Estructura de Proteína Terciaria
- Page ID
- 73131
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \) \( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)\(\newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\) \( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\) \( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\) \( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\) \( \newcommand{\Span}{\mathrm{span}}\) \(\newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\) \( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\) \( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\) \( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\) \( \newcommand{\Span}{\mathrm{span}}\)\(\newcommand{\AA}{\unicode[.8,0]{x212B}}\)
- Objetivo 1
- Objetivo 2
La estructura terciaria se refiere a la forma tridimensional única de la proteína como un todo, que resulta del plegamiento y flexión de la cadena principal de la proteína. La estructura terciaria está íntimamente ligada al correcto funcionamiento bioquímico de la proteína. La Figura\(\PageIndex{1}\) muestra una representación de la estructura tridimensional de la insulina.

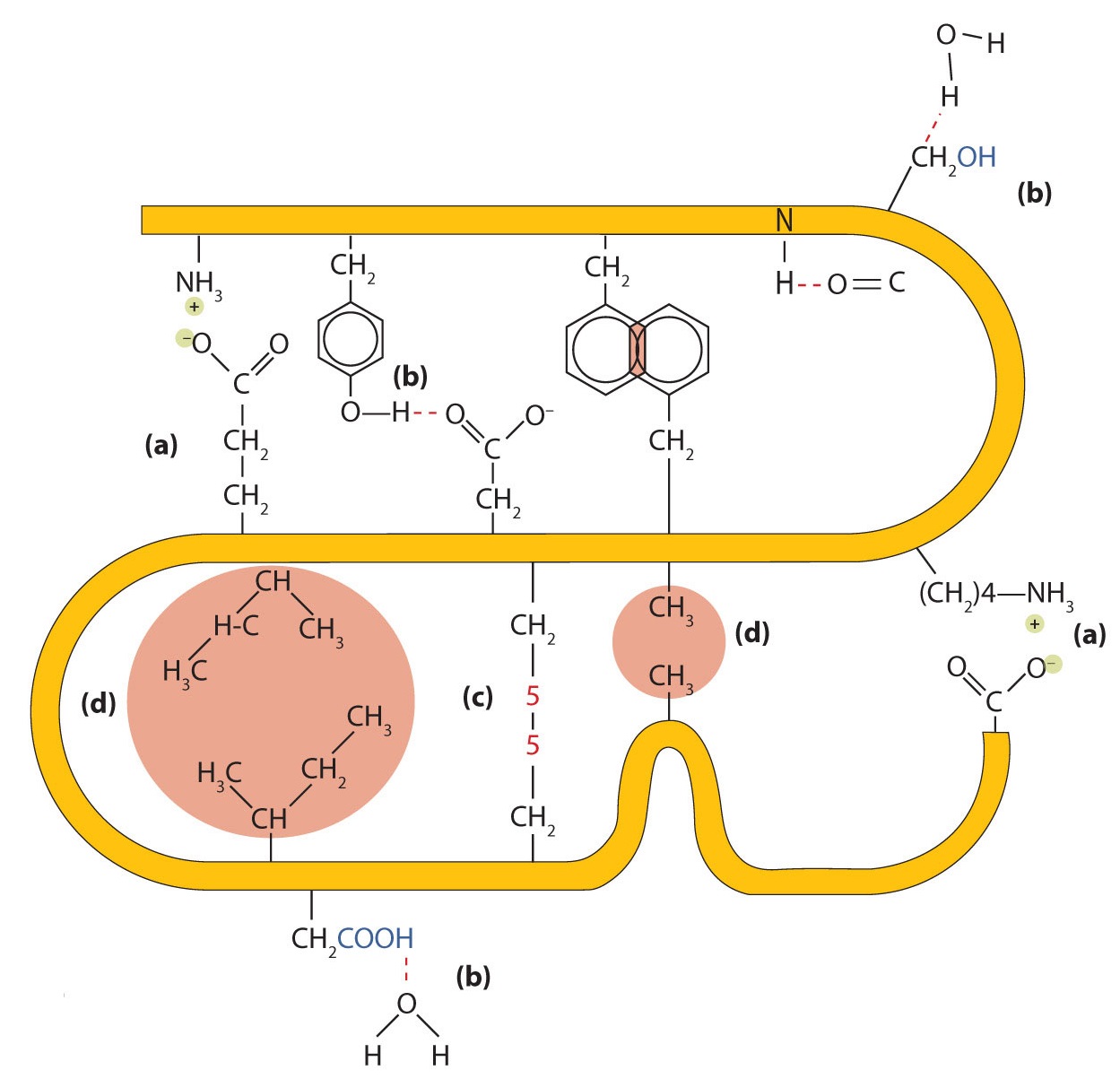
Cuatro tipos principales de interacciones atractivas determinan la forma y estabilidad de la estructura terciaria de las proteínas. Estudiaste varios de ellos previamente.
- Unión iónica. Los enlaces iónicos son el resultado de atracciones electrostáticas entre cadenas laterales de aminoácidos con carga positiva y negativa. Por ejemplo, la atracción mutua entre un ion carboxilato de ácido aspártico y un ion lisina amonio ayuda a mantener un área plegada particular de una proteína (parte (a) de la Figura\(\PageIndex{5}\)).
- Enlace de hidrógeno. Los enlaces de hidrógeno se forman entre un átomo de oxígeno altamente electronegativo o un átomo de nitrógeno y un átomo de hidrógeno unido a otro átomo de oxígeno o un átomo de nitrógeno, como los que se encuentran en las cadenas laterales de aminoácidos polares. Los enlaces de hidrógeno (así como las atracciones iónicas) son extremadamente importantes tanto en las interacciones intra como intermoleculares de las proteínas (parte (b) de la Figura\(\PageIndex{5}\)).
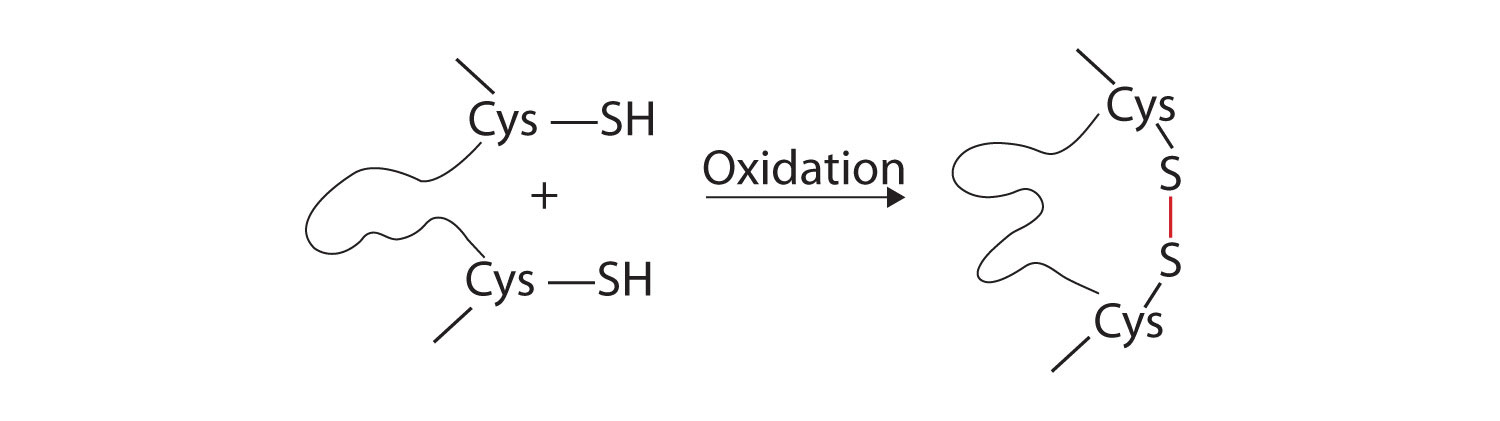
- Enlaces disulfuro. Dos unidades de aminoácidos de cisteína se pueden acercar juntas a medida que la molécula de proteína se pliega. La posterior oxidación y unión de los átomos de azufre en los grupos sulfhidrilo (SH) altamente reactivos conduce a la formación de cistina (parte (c) de la Figura\(\PageIndex{2}\)). Los enlaces disulfuro intracatenarios se encuentran en muchas proteínas, incluida la insulina (barras amarillas en la Figura\(\PageIndex{1}\)) y tienen un fuerte efecto estabilizador sobre la estructura terciaria.
- Fuerzas de dispersión. Las fuerzas de dispersión surgen cuando un átomo normalmente no polar se vuelve momentáneamente polar debido a una distribución desigual de electrones, lo que lleva a un dipolo instantáneo que induce un desplazamiento de electrones en un átomo no polar vecino. Las fuerzas de dispersión son débiles pero pueden ser importantes cuando faltan otros tipos de interacciones o son mínimas (parte (d) de la Figura\(\PageIndex{2}\)). Este es el caso de la fibroína, la proteína principal en la seda, en la que una alta proporción de aminoácidos en la proteína tienen cadenas laterales no polares. El término interacción hidrofóbica a menudo se usa mal como sinónimo de fuerzas de dispersión. Las interacciones hidrofóbicas surgen porque las moléculas de agua se involucran en enlaces de hidrógeno con otras moléculas de agua (o grupos en proteínas capaces de formar enlaces de hidrógeno) Debido a que los grupos no polares no pueden participar en enlaces de hidrógeno, la proteína se pliega de tal manera que estos grupos quedan enterrados en la parte interior de la estructura proteica, minimizando su contacto con el agua.