4.3: Ley de Proporciones Múltiples
- Page ID
- 70336
¿Cuáles son las similitudes y diferencias entre un monociclo y una bicicleta?
Apenas por las propias palabras, el astuto erudito de habla latina puede decir que, de lo que sea que esté hecho, el monociclo tiene uno de ellos (uni = “uno”) y la bicicleta tiene dos (bi = “dos”). A partir de las imágenes, obtenemos información adicional que nos ayuda a distinguir a los dos. El monociclo tiene una rueda y la bicicleta tiene dos. En particular, están conformadas con los mismos materiales, y la única diferencia significativa es el número de ruedas en los dos vehículos. Ahora, ¿cuántas ruedas hay en un triciclo?
Ley de Múltiples Proporciones
Una vez establecida la idea de que los elementos se combinaban en proporciones definidas para formar compuestos, los experimentos también comenzaron a demostrar que los mismos pares de ciertos elementos podían combinarse para formar más de un compuesto. Considera los elementos carbono y oxígeno. Combinados de una manera, forman el compuesto familiar dióxido de carbono. En cada muestra de dióxido de carbono, hay\(32.0 \: \text{g}\) oxígeno presente por cada\(12.0 \: \text{g}\) carbono. Al dividir\(32.0\) por\(12.0\), esto simplifica a una relación másica de oxígeno a carbono de 2.66 a 1. Hay otro compuesto que se forma a partir de la combinación de carbono y oxígeno llamado monóxido de carbono. Cada muestra de monóxido\(16.0 \: \text{g}\) de carbono contiene oxígeno por cada\(12.0 \: \text{g}\) carbono. Esta es una relación másica de oxígeno a carbono de 1.33 a 1. En el dióxido de carbono, hay exactamente el doble de oxígeno presente que en el monóxido de carbono. Este ejemplo ilustra la ley de múltiples proporciones: siempre que los mismos dos elementos formen más de un compuesto, las diferentes masas de un elemento que se combinan con la misma masa del otro elemento están en la proporción de números enteros pequeños.
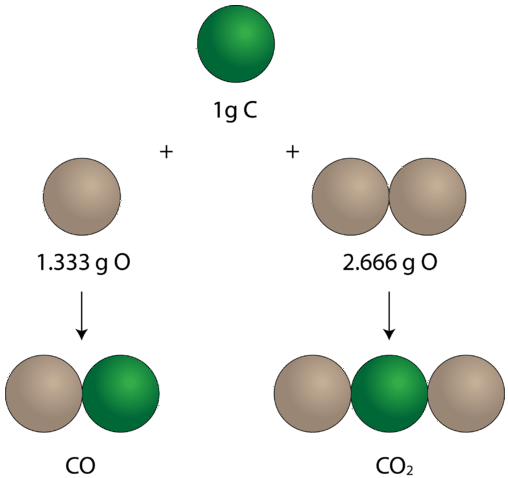
En el monóxido de carbono, a la izquierda, hay\(1.333 \: \text{g}\) de oxígeno por cada\(1 \: \text{g}\) carbono. En el dióxido de carbono, a la derecha, hay\(2.666 \: \text{g}\) de oxígeno por cada gramo de carbono. Entonces la relación de oxígeno en los dos compuestos es 1:2, una pequeña relación de número entero.
La diferencia entre monóxido de carbono y dióxido de carbono es significativa. El monóxido de carbono es un gas mortal, formado a partir de la combustión incompleta de algunos materiales que contienen carbono (como la madera y la gasolina). Este compuesto se adherirá a la hemoglobina en los glóbulos rojos y bloqueará la unión del oxígeno a esas células. Si el oxígeno no se une, no se puede llevar a las células del cuerpo donde se necesita, y puede ocurrir la muerte. El dióxido de carbono, por otro lado, no es tóxico como lo es el monóxido de carbono. Sin embargo, puede desplazar el oxígeno en los sistemas ya que es más pesado. Los extintores de dióxido de carbono cortan el flujo de oxígeno en un incendio, apagando el fuego.
Resumen
- La ley de proporciones múltiples establece que siempre que los mismos dos elementos formen más de un compuesto, las diferentes masas de un elemento que se combinan con la misma masa del otro elemento están en la proporción de números enteros pequeños.
Revisar
- Declarar la ley de múltiples proporciones.
- En dióxido de carbono (CO2), ¿cuántos gramos de oxígeno (O) habría si hay 24 gramos de carbono (C)?
- ¿Cuántos gramos de carbono (C) estarían presentes en el monóxido de carbono (CO) que contiene 2.666 gramos de oxígeno (O)?

