8.8: Número de Coordinación
- Page ID
- 70952
¿Qué hace que los colores sean diferentes?
Las sales de cobalto contienen\(\ce{Co^{2+}}\) cationes. Las diferencias en el color de las sales se deben a las especies que rodean el ion cobalto. La presencia de moléculas de agua en la esfera de coordinación alrededor del ion cobalto central cambia las distancias entre especies y el color del material.
Número de Coordinación
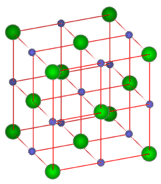
El número de coordinación es el número de iones que rodean inmediatamente un ion de la carga opuesta dentro de una red cristalina. Si examina la figura a continuación, verá que hay seis iones cloruro que rodean inmediatamente a un solo ion sodio. El número de coordinación de sodio es 6. De igual manera, seis iones sodio rodean inmediatamente cada ion cloruro, haciendo que el número de coordinación del cloruro también sea igual a 6. Debido a que la unidad de fórmula de cloruro de sodio muestra una relación 1:1 entre los iones, los números de coordinación deben ser los mismos.
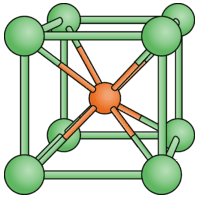
La unidad de fórmula para el cloruro de cesio es\(\ce{CsCl}\), también una relación 1:1. No obstante, como se muestra en la siguiente figura, los números de coordinación no son 6 como en\(\ce{NaCl}\). El ion central es el\(\ce{Cs^+}\) ion y está rodeado por los ocho\(\ce{Cl^-}\) iones en las esquinas del cubo. Cada\(\ce{Cl^-}\) ion también está rodeado por ocho\(\ce{Cs^+}\) iones. Los números de coordinación en este tipo de cristales son ambos 8. \(\ce{CsCl}\)y\(\ce{NaCl}\) no adopten disposiciones idénticas de empaque de cristal porque\(\ce{Cs^+}\) es considerablemente más grande que el\(\ce{Na^+}\) ion.
Otro tipo de cristal se ilustra por el óxido de titanio (IV)\(\ce{TiO_2}\), que comúnmente se conoce como rutilo. A continuación se muestra el cristal de rutilo.
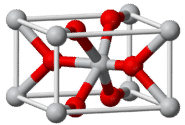
Los\(\ce{Ti^{4+}}\) iones grises están rodeados por seis\(\ce{O^{2-}}\) iones rojos. Los\(\ce{O^{2-}}\) iones están rodeados por tres\(\ce{Ti^{4+}}\) iones. La coordinación del catión titanio (IV) es 6, que es el doble del número de coordinación del anión óxido, que es 3. Esto encaja con la fórmula unidad de\(\ce{TiO_2}\), ya que hay el doble de\(\ce{O^{2-}}\) iones que\(\ce{Ti^{4+}}\) iones.
La estructura cristalina de todos los compuestos iónicos debe reflejar la unidad de fórmula. En un cristal de cloruro de hierro (III)\(\ce{FeCl_3}\),, hay tres veces más iones cloruro que iones hierro (III).
Resumen
- El número de coordinación de un compuesto está determinado por el tipo y número de iones u otras especies que rodean un ion central.
- A menudo el color de un compuesto se ve afectado por los materiales específicos coordinados a ese ion central.
Revisar
- ¿Cuál es el número de coordinación para Na+ en NaCl?
- ¿Cuál es el número de coordinación para Cs+?
- ¿Por qué son diferentes los arreglos de empaque para Na+ y Cs+?

