9.9: Enlace Covalente en Iones Poliatómicos
- Page ID
- 70373
¿Cómo extendemos los principios básicos?
El Tribunal Supremo de Estados Unidos tiene la tarea poco envidiable de determinar lo que dicta la ley. Esta responsabilidad puede ser un reto importante cuando no hay un principio claro involucrado, o cuando se enfrentan a una situación que no se encontraba previamente. La química enfrenta el mismo desafío al extender los conceptos básicos para adaptarse a una nueva situación. El dibujo de las estructuras de Lewis para iones poliatómicos utiliza el mismo enfoque, pero ajusta un poco el proceso para adaptarse a un conjunto de circunstancias algo diferente.
Iones Poliatómicos
Recordemos que un ion poliatómico es un grupo de átomos que están unidos covalentemente entre sí, y que llevan una carga eléctrica general. El ion amonio,\(\ce{NH_4^+}\), se forma cuando un ión hidrógeno\(\left( \ce{H^+} \right)\) se une al par solitario de una\(\left( \ce{NH_3} \right)\) molécula de amoníaco en un enlace covalente coordinado.
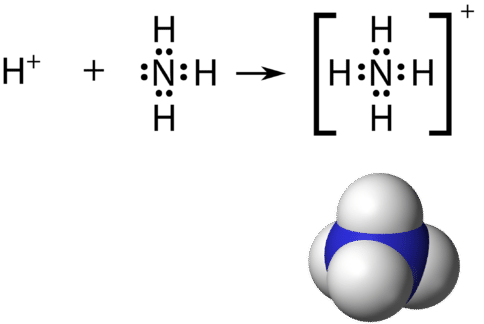
Al dibujar la estructura de Lewis de un ion poliatómico, la carga del ion se refleja en el número de electrones de valencia total en la estructura. En el caso del ion amonio:
\(1 \: \ce{N}\)electrones de\(= 5\) valencia de átomos
\(4 \: \ce{H}\)átomos\(= 4 \times 1 = 4\) valencia electrones
restar 1 electrón para la\(1+\) carga del ion
total de 8 electrones de valencia en el ion
Se acostumbra poner la estructura Lewis de un ion poliatómico en un gran conjunto de corchetes, con la carga del ion como un superíndice fuera de los corchetes.
Ejemplo\(\PageIndex{1}\)
Dibuje la estructura de punto de electrones de Lewis para el ion sulfato.
Solución
Paso 1: Enumere las cantidades conocidas y planifique el problema.
Conocido
Fórmula molecular del ion sulfato:\( \ce{SO_4^{2-}}\)
\(1 \: \ce{S}\)electrones de\(= 6\) valencia de átomos
\(4 \: \ce{O}\)átomos\(= 4 \times 6 = 24\) valencia electrones
añadir 2 electrones para la\(2-\) carga del ion
= total de 32 electrones de valencia
El átomo de azufre menos electronegativo es el átomo central en la estructura. Colocar los átomos de oxígeno alrededor del átomo de azufre, cada uno con un solo enlace covalente. Distribuir pares solitarios a cada átomo de oxígeno para satisfacer la regla del octeto. Contar el número total de átomos. Si hay demasiados electrones en la estructura, hacer múltiples enlaces entre el\(\ce{S}\) y\(\ce{O}\).
Paso 2: Resolver.
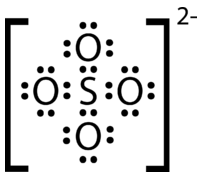
Paso 3: Piensa en tu resultado.
La estructura de Lewis para el ion sulfato consiste en un átomo central de azufre con cuatro enlaces simples a átomos de oxígeno. Esto produce el total esperado de 32 electrones. Dado que el átomo de azufre comenzó con seis electrones de valencia, dos de los\(\ce{S-O}\) enlaces son covalentes coordinados.
Resumen
- Las estructuras de Lewis para iones poliatómicos siguen las mismas reglas que las de otros compuestos covalentes.
Revisar
- ¿Cuáles son dos características de los iones poliatómicos?
- ¿Qué átomo se convierte en el átomo central en la estructura?
- ¿Dónde se coloca la carga de un ion en un diagrama de puntos de lewis?

