9.14: Formas moleculares- Sin pares solitarios en átomos centrales
- Page ID
- 70413
¿Cómo funciona un electroscopio?
Un electroscopio es un dispositivo utilizado para estudiar la carga. Cuando un objeto cargado positivamente (la varilla) se acerca al poste superior, los electrones fluyen hacia la parte superior de la jarra, dejando las dos hojas de oro cargadas positivamente. Las hojas se repelen entre sí ya que ambas mantienen positivas, como cargas. La teoría de VSEPR dice que los pares de electrones, también un conjunto de cargas similares, se repelerán entre sí de tal manera que la forma de la molécula se ajustará, de manera que los pares de electrones de valencia permanezcan lo más alejados posible entre sí.
Átomo Central sin Pares Solitarios
Para entender fácilmente los tipos de moléculas posibles, utilizaremos un sistema sencillo para identificar las partes de cualquier molécula:
- A = átomo central en una molécula
- B = átomos que rodean el átomo central
Los subíndices después del B denotarán el número de átomos B que están unidos al átomo A central. Por ejemplo, AB\(_4\) es una molécula con un átomo central rodeado por cuatro átomos unidos covalentemente. Nuevamente, no importa si esos bonos son simples, dobles o triples.
AB\(_2\): hidruro de berilio\(\left( \ce{BeH_2} \right)\)
El hidruro de berilio consiste en un átomo central de berilio con dos enlaces simples a átomos de hidrógeno. Recordemos que viola la regla del octeto.
\[\ce{H-Be-H}\nonumber \]
De acuerdo con el requisito de que los pares de electrones maximicen su distancia entre sí, los dos pares de enlace en las\(\ce{BeH_2}\) moléculas se dispondrán en lados directamente opuestos del\(\ce{Be}\) átomo central. La geometría resultante es una molécula lineal, mostrada en la siguiente figura en un modelo de “bola y palo”.
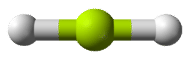
El ángulo de unión de\(\ce{H-Be-H}\) es\(180^\text{o}\) debido a su geometría lineal.
El dióxido de carbono es otro ejemplo de una molécula que pertenece a la\(_2\) categoría AB. Su estructura de Lewis consiste en dobles enlaces entre el carbono central y los átomos de oxígeno (ver figura abajo).
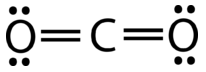
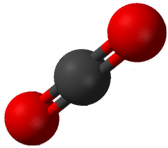
La repulsión entre los dos grupos de cuatro electrones (dos pares) no es diferente a la repulsión de los dos grupos de dos electrones (un par) en la\(\ce{BeH_2}\) molécula. El dióxido de carbono también es lineal (véase la figura a continuación).
AB\(_3\): Trifluoruro de boro\(\left( \ce{BF_3} \right)\)
El trifluoruro de boro consiste en un átomo central de boro con tres enlaces simples a los átomos de flúor (ver figura a continuación). El átomo de boro también tiene un octeto incompleto.
La geometría de la\(\ce{BF_3}\) molécula se denomina plano trigonal (figura\(\PageIndex{3}\)). Los átomos de flúor están posicionados en los vértices de un triángulo equilátero. El\(\ce{F-B-F}\) ángulo es\(120^\text{o}\) y los cuatro átomos se encuentran en el mismo plano.
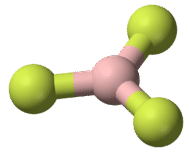
AB\(_4\): Metano\(\left( \ce{CH_4} \right)\)
El metano es un compuesto orgánico que es el componente principal del gas natural. Su estructura consiste en un átomo de carbono central con cuatro enlaces simples a átomos de hidrógeno (ver figura a continuación). Para maximizar su distancia entre sí, los cuatro grupos de electrones de unión no se encuentran en el mismo plano. En cambio, cada uno de los átomos de hidrógeno se encuentra en las esquinas de una forma geométrica llamada tetraedro. El átomo de carbono está en el centro del tetraedro. Cada cara de un tetraedro es un triángulo equilátero.
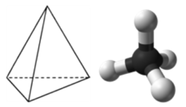
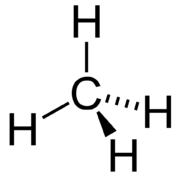
La geometría molecular de la molécula de metano es tetraédrica (ver figura\(\PageIndex{5}\)). Los ángulos de\(\ce{H-C-H}\) enlace son\(109.5^\text{o}\), que es mayor\(90^\text{o}\) que el que serían si la molécula fuera plana. Al dibujar una fórmula estructural para una molécula como el metano, es ventajoso poder indicar el carácter tridimensional de su forma. La fórmula estructural a continuación se llama un dibujo en perspectiva. El enlace de línea punteada debe visualizarse como retrocediendo hacia la página, mientras que el enlace de triángulo sólido se va a visualizar como saliendo de la página.
Resumen
- Los pares de electrones se repelen mutuamente e influyen en los ángulos de enlace y la forma molecular.
Revisar
- ¿Cuáles son los ángulos de enlace en el dióxido de carbono?
- ¿Qué molécula tiene ángulos de enlace de 109.5 °?
- ¿Cuál es la geometría de la molécula BF 3?

