9.15: Formas Moleculares - Par (s) Solitario en Átomo Central
- Page ID
- 70381
¿Cómo puede caber toda esta ropa en un espacio tan pequeño?
Cuando viajamos, a menudo tomamos muchas más cosas de las que necesitamos. Tratar de meterlo todo en una maleta puede ser un verdadero desafío. Puede que tengamos que volver a embalar o simplemente apretarlo todo. Los átomos a menudo tienen que reorganizarse donde están los electrones para crear una estructura más estable.
Átomo central con uno o más pares solitarios
Las geometrías moleculares de las moléculas cambian cuando el átomo central tiene uno o más pares solitarios de electrones. El número total de pares de electrones, tanto pares de enlace como pares solitarios, conduce a lo que se denomina geometría del dominio electrónico. Cuando uno o más de los pares de unión de electrones se reemplazan por un par solitario, se altera la geometría molecular (forma real) de la molécula. De acuerdo con los símbolos A y B establecidos en la sección anterior, usaremos E para representar un par solitario en el átomo central (A). Se utilizará un subíndice cuando haya más de un par solitario. Los pares solitarios en los átomos circundantes (B) no afectan la geometría.
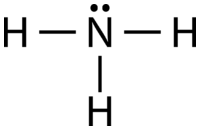
AB\(_3\) E: Amoníaco,\(\ce{NH_3}\)
La molécula de amoníaco contiene tres enlaces simples y un par solitario en el átomo de nitrógeno central (ver figura a continuación).
La geometría del dominio para una molécula con cuatro pares de electrones es tetraédrica, como se vio con\(\ce{CH_4}\). En la molécula de amoníaco, uno de los pares de electrones es un par solitario en lugar de un par de enlace. La geometría molecular de\(\ce{NH_3}\) se llama piramidal trigonal (ver figura abajo).
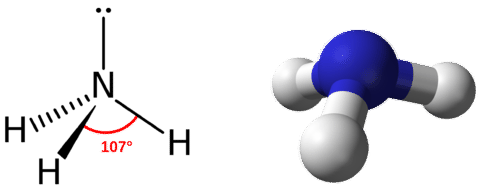
Recordemos que el ángulo de enlace en la\(\ce{CH_4}\) molécula tetraédrica es\(109.5^\text{o}\). Nuevamente, la sustitución de uno de los pares de electrones unidos por un par solitario comprime ligeramente el ángulo. El\(\ce{H-N-H}\) ángulo es aproximadamente\(107^\text{o}\).
AB\(_2\) E\(_2\): Agua,\(\ce{H_2O}\)
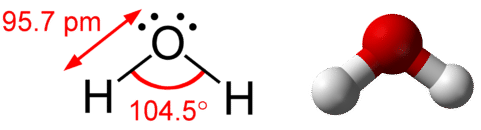
Una molécula de agua consiste en dos pares de unión y dos pares solitarios (ver figura a continuación).

En cuanto al metano y amoníaco, la geometría del dominio para una molécula con cuatro pares de electrones es tetraédrica. En la molécula de agua, dos de los pares de electrones son pares solitarios en lugar de pares de unión. La geometría molecular de la molécula de agua está doblada. El ángulo de\(\ce{H-O-H}\) unión es\(104.5^\text{o}\), que es menor que el ángulo de unión en\(\ce{NH_3}\) (ver figura a continuación).
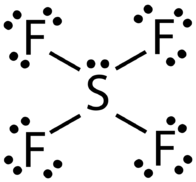
AB\(_4\) E: Tetrafluoruro de azufre,\(\ce{SF_4}\)
La estructura de Lewis para\(\ce{SF_4}\) contiene cuatro enlaces simples y un par solitario en el átomo de azufre (ver figura abajo).
El átomo de azufre tiene cinco grupos de electrones a su alrededor, lo que corresponde a la geometría del dominio bipiramidal trigonal, como en\(\ce{PCl_5}\) (ver figura a continuación). Recordemos que la geometría bipiramidal trigonal tiene tres átomos ecuatoriales y dos átomos axiales unidos al átomo central. Debido a la mayor repulsión de un par solitario, es uno de los átomos ecuatoriales que son reemplazados por un par solitario. La geometría de la molécula se llama tetraedro distorsionado, o balancín.
| Número total de pares de electrones | Número de pares de unión | Número de Pares Solitarios | Geometría de dominio electrónico | Geometría Molecular | Ejemplos |
|---|---|---|---|---|---|
| 3 | 2 | 1 | Plano Trigonal | Doblada | \(\ce{O_3}\) |
| 4 | 3 | 1 | Tetraédrico | Piramidal Trigonal | \(\ce{NH_3}\) |
| 4 | 2 | 2 | Tetraédrico | Doblada | \(\ce{H_2O}\) |
| 5 | 4 | 1 | Trigonal Bipiramidal | Tetraedro Distorsionado | \(\ce{SF_4}\) |
| 5 | 3 | 2 | Trigonal Bipiramidal | En forma de T | \(\ce{ClF_3}\) |
| 5 | 2 | 3 | Trigonal Bipiramidal | Lineal | \(\ce{I_3^-}\) |
| 6 | 5 | 1 | Octaédrica | Plaza piramidal | \(\ce{BrF_5}\) |
| 6 | 4 | 2 | Octaédrica | Plano Cuadrado | \(\ce{XeF_4}\) |
Resumen
- La presencia de electrones de par solitario influye en la forma tridimensional de la molécula.
Revisar
- ¿Por qué el agua tiene una geometría doblada?
- ¿Por qué el amoníaco no es una molécula plana?
- ¿Cómo escribiríamos la configuración del tetrafluoruro de xenón usando el sistema ABE?


