9.16: Polaridad de enlace
- Page ID
- 70400
¿Qué hace que la gente comparta?
¿Alguna vez has pasado tiempo con alguien que realmente no te gustó? No tenías nada en común con ellos y no querías tener nada que ver con ellos. Por otro lado, hay gente con la que disfrutas estar. Tienes mucho en común y te gusta compartir con ellos. Los átomos funcionan de la misma manera. Si hay fuertes diferencias en su atracción de electrones, un átomo obtiene los electrones y el otro átomo los pierde. Si son similares, comparten electrones para formar un enlace covalente.
Polaridad de enlace
La electronegatividad se define como la capacidad de un átomo para atraer electrones cuando los átomos están en un compuesto. Las electronegatividades de los elementos se muestran en la siguiente tabla periódica.
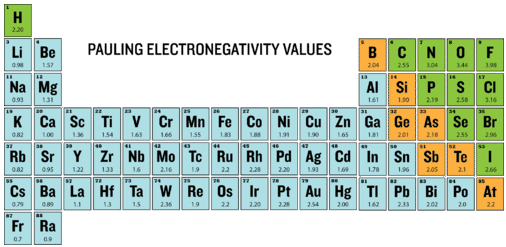
El grado en que un enlace dado es iónico o covalente se determina calculando la diferencia de electronegatividad entre los dos átomos involucrados en el enlace.
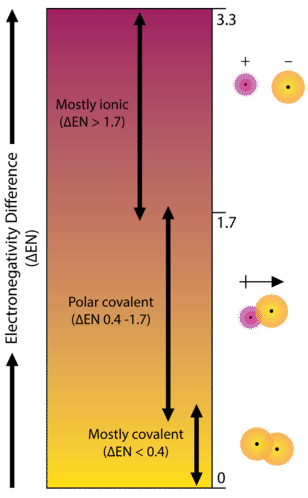
Como ejemplo, considere el enlace que se produce entre un átomo de potasio y un átomo de flúor. Usando la tabla, la diferencia en electronegatividad es igual a\(4.0 - 0.8 = 3.2\). Dado que la diferencia en la electronegatividad es relativamente grande, el enlace entre los dos átomos es iónico. Dado que el átomo de flúor tiene una atracción mucho mayor para los electrones que el átomo de potasio, el electrón de valencia del átomo de potasio se transfiere completamente al átomo de flúor. El siguiente diagrama muestra cómo la diferencia en la electronegatividad se relaciona con el carácter iónico o covalente de un enlace químico.
Enlaces covalentes no polares
Un enlace en el que la diferencia de electronegatividad es menor de 1.7 se considera que es mayormente de carácter covalente. Sin embargo, en este punto necesitamos distinguir entre dos tipos generales de enlaces covalentes. Un enlace covalente no polar es un enlace covalente en el que los electrones de enlace se comparten por igual entre los dos átomos. En un enlace covalente no polar, la distribución de la carga eléctrica se equilibra entre los dos átomos.
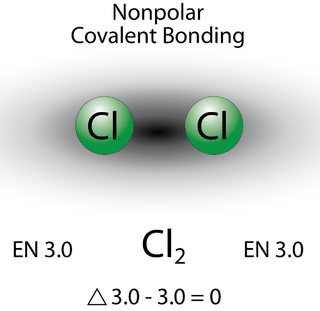
Los dos átomos de cloro comparten el par de electrones en el enlace covalente simple por igual, y la densidad de electrones que rodea a la\(\ce{Cl_2}\) molécula es simétrica. Tenga en cuenta que las moléculas en las que la diferencia de electronegatividad es muy pequeña (<0.4) también se consideran covalentes no polares. Un ejemplo sería un enlace entre cloro y bromo (\(\Delta\)EN\(=3.0 - 2.8 = 0.2\)).
Enlaces Covalentes Polares
Un enlace en el que la diferencia de electronegatividad entre los átomos está entre 0.4 y 1.7 se denomina enlace covalente polar. Un enlace covalente polar es un enlace covalente en el que los átomos tienen una atracción desigual por los electrones, por lo que la compartición es desigual. En un enlace covalente polar, a veces simplemente llamado enlace polar, la distribución de electrones alrededor de la molécula ya no es simétrica.
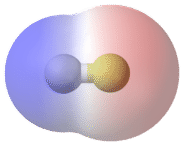
Una manera fácil de ilustrar la distribución desigual de electrones en un enlace covalente polar es usar la letra griega delta\(\left( \delta \right)\).

El átomo con mayor electronegatividad adquiere una carga negativa parcial, mientras que el átomo con la electronegatividad menor adquiere una carga positiva parcial. El símbolo delta se utiliza para indicar que la cantidad de carga es menor a uno. También se puede utilizar una flecha cruzada para indicar la dirección de mayor densidad de electrones.
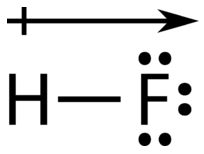
Fuente: Fundación CK-12; Licencia: CC BY-NC 3.0 (opens in new window))
Si no fuera por nuestra comprensión de la polaridad de los bonos, nos sería muy difícil limpiar nuestra ropa. ¡Usa esta simulación para entender cómo la polaridad única de las moléculas de jabón ayuda a limpiar nuestra ropa!
Resumen
- La electronegatividad de un átomo determina con qué fuerza atrae electrones hacia sí mismo.
- La polaridad de un enlace se ve afectada por los valores de electronegatividad de los dos átomos involucrados en ese enlace.
Revisar
- Si dos átomos unidos entre sí tienen una diferencia de electronegatividad de 1.9, ¿cuál es el tipo de enlace?
- ¿Cuál sería el tipo de enlace para BH 2?
- Tu amigo te dice que el enlace LiF es covalente. ¿Están en lo correcto? Por qué o por qué no.

