9.17: Moléculas polares
- Page ID
- 70380
¿Qué tan frías son las moléculas polares ultrafrías?
Las moléculas polares ultrafrías han sido creadas por investigadores científicos. Estas “moléculas” consisten en\(\ce{Rb}\) y\(\ce{K}\) átomos excitados por láseres para formar un tipo de\(\ce{Rb-K}\) compuesto donde el\(\ce{Rb}\) tiene una carga positiva y el\(\ce{K}\) tiene una carga negativa. El material se forma a temperaturas extremadamente cercanas al cero absoluto. Los investigadores creen que estas técnicas les ayudarán a hacer nuevas reacciones y nuevos materiales.
Moléculas polares
Una molécula polar es una molécula en la que un extremo de la molécula es ligeramente positivo, mientras que el otro extremo es ligeramente negativo. Una molécula diatómica que consiste en un enlace covalente polar, tal como\(\ce{HF}\), es una molécula polar. Las dos regiones cargadas eléctricamente en cada extremo de la molécula se denominan polos, similares a un imán que tiene un polo norte y otro sur. Una molécula con dos polos se llama dipolo (ver figura abajo). El fluoruro de hidrógeno es un dipolo.

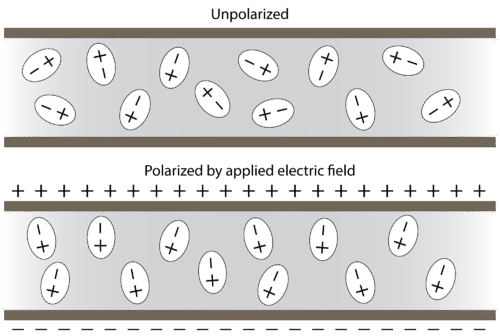
Las moléculas polares se orientan en presencia de un campo eléctrico con los extremos positivos de la molécula siendo atraídos hacia la placa negativa, mientras que los extremos negativos de las moléculas son atraídos hacia la placa positiva (ver figura a continuación).
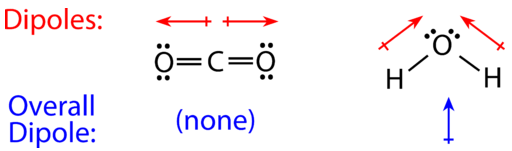
Para las moléculas con más de dos átomos, también se debe tomar en cuenta la geometría molecular a la hora de determinar si la molécula es polar o no polar. La siguiente figura muestra una comparación entre dióxido de carbono y agua. \(\left( \ce{CO_2} \right)\)El dióxido de carbono es una molécula lineal. Los átomos de oxígeno son más electronegativos que el átomo de carbono, por lo que hay dos dipolos individuales que apuntan hacia afuera desde el\(\ce{C}\) átomo hacia cada\(\ce{O}\) átomo. Sin embargo, dado que los dipolos son de igual fuerza y están orientados de esta manera, se cancelan, y la polaridad molecular general de\(\ce{CO_2}\) es cero.
El agua es una molécula doblada debido a los dos pares solitarios en el átomo de oxígeno central. Los dipolos individuales apuntan desde los\(\ce{H}\) átomos hacia el\(\ce{O}\) átomo. Debido a la forma, los dipolos no se cancelan entre sí, y la molécula de agua es polar. En la siguiente figura, el dipolo neto se muestra en azul y apunta hacia arriba.
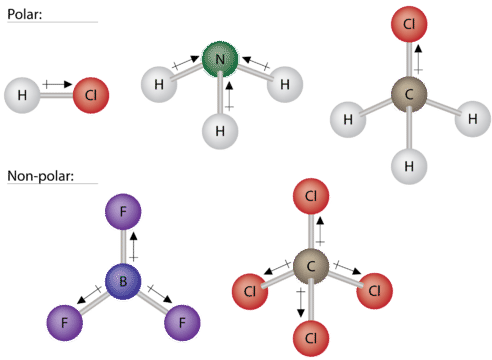
Algunas otras moléculas se muestran en la siguiente figura. Observe que una molécula tetraédrica como\(\ce{CH_4}\) es no polar. Sin embargo, si uno de los\(\ce{H}\) átomos periféricos es reemplazado por otro átomo que tiene una electronegatividad diferente, la molécula se vuelve polar. Una molécula plana trigonal\(\left( \ce{BF_3} \right)\) puede ser no polar si los tres átomos periféricos son iguales, pero una molécula piramidal trigonal\(\left( \ce{NH_3} \right)\) es polar.
¿Por qué el agua forma gotitas? ¿Cómo limpia el jabón nuestra ropa? Pista: ambas acciones tienen que ver con la polaridad. Pruebe estas simulaciones para obtener más información:
Resumen
- Las moléculas polares son el resultado de diferencias en la electronegatividad de los átomos en la molécula.
- Los dipolos que están directamente opuestos entre sí se cancelan entre sí.
Revisar
- ¿Por qué una molécula polar se llama dipolo?
- La geometría molecular del NH 3 es piramidal trigonal. ¿Qué pasa con la geometría molecular del NH 3 lo convierte en una molécula polar?
- ¿Qué sucede con las moléculas polares cuando se aplica un campo eléctrico?

