14.4: Ley de Carlos
- Page ID
- 71097
El pan recién horneado es ligero y esponjoso como resultado de la acción de la levadura sobre el azúcar. La levadura convierte el azúcar en dióxido de carbono, que a altas temperaturas hace que la masa se expanda. El resultado final es una delicia agradable, especialmente cuando se cubre con mantequilla derretida.
Ley de Carlos
El físico francés Jacques Charles (1746-1823) estudió el efecto de la temperatura sobre el volumen de un gas a presión constante. La Ley de Carlos establece que el volumen de una masa dada de gas varía directamente con la temperatura absoluta del gas cuando la presión se mantiene constante. La temperatura absoluta es la temperatura medida con la escala Kelvin. Se debe usar la escala Kelvin porque cero en la escala Kelvin corresponde a una detención completa del movimiento molecular.
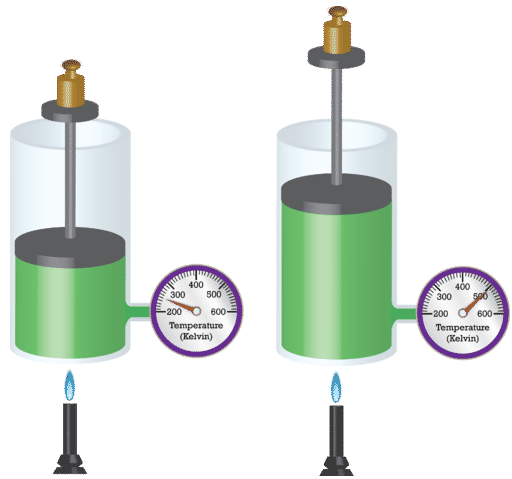
Matemáticamente, la relación directa de la Ley de Carlos puede ser representada por la siguiente ecuación:
\[\frac{V}{T} = k\nonumber \]
Al igual que con la Ley de Boyle,\(k\) es constante sólo para una muestra de gas dada. La siguiente tabla muestra los datos de temperatura y volumen para una cantidad establecida de gas a presión constante. La tercera columna es la constante para este conjunto de datos en particular y siempre es igual al volumen dividido por la temperatura Kelvin.
| Temperatura\(\left( \text{K} \right)\) | Volumen\(\left( \text{mL} \right)\) | \(\frac{V}{T} = k\)\(\left( \frac{\text{mL}}{\text{K}} \right)\) |
|---|---|---|
| \ (\ left (\ text {K}\ right)\)” style="vertical-align:middle; text-align:center; ">50 | \ (\ left (\ text {mL}\ right)\)” style="vertical-align:middle; text-align:center; ">20 | \ (\ frac {V} {T} = k\)\(\left( \frac{\text{mL}}{\text{K}} \right)\) "style="vertical-align:middle; text-align:center;" >0.40 |
| \ (\ left (\ text {K}\ right)\)” style="vertical-align:middle; text-align:center; ">100 | \ (\ left (\ text {mL}\ right)\)” style="vertical-align:middle; text-align:center; ">40 | \ (\ frac {V} {T} = k\)\(\left( \frac{\text{mL}}{\text{K}} \right)\) "style="vertical-align:middle; text-align:center;" >0.40 |
| \ (\ left (\ text {K}\ right)\)” style="vertical-align:middle; text-align:center; ">150 | \ (\ left (\ text {mL}\ right)\)” style="vertical-align:middle; text-align:center; ">60 | \ (\ frac {V} {T} = k\)\(\left( \frac{\text{mL}}{\text{K}} \right)\) "style="vertical-align:middle; text-align:center;" >0.40 |
| \ (\ left (\ text {K}\ right)\)” style="vertical-align:middle; text-align:center; ">200 | \ (\ left (\ text {mL}\ right)\)” style="vertical-align:middle; text-align:center; ">80 | \ (\ frac {V} {T} = k\)\(\left( \frac{\text{mL}}{\text{K}} \right)\) "style="vertical-align:middle; text-align:center;" >0.40 |
| \ (\ left (\ text {K}\ right)\)” style="vertical-align:middle; text-align:center; ">300 | \ (\ left (\ text {mL}\ right)\)” style="vertical-align:middle; text-align:center; ">120 | \ (\ frac {V} {T} = k\)\(\left( \frac{\text{mL}}{\text{K}} \right)\) "style="vertical-align:middle; text-align:center;" >0.40 |
| \ (\ left (\ text {K}\ right)\)” style="vertical-align:middle; text-align:center; ">500 | \ (\ left (\ text {mL}\ right)\)” style="vertical-align:middle; text-align:center; ">200 | \ (\ frac {V} {T} = k\)\(\left( \frac{\text{mL}}{\text{K}} \right)\) "style="vertical-align:middle; text-align:center;" >0.40 |
| \ (\ left (\ text {K}\ right)\)” style="vertical-align:middle; text-align:center; ">1000 | \ (\ left (\ text {mL}\ right)\)” style="vertical-align:middle; text-align:center; ">400 | \ (\ frac {V} {T} = k\)\(\left( \frac{\text{mL}}{\text{K}} \right)\) "style="vertical-align:middle; text-align:center;" >0.40 |
Cuando se grafica estos datos, el resultado es una línea recta, indicativa de una relación directa, que se muestra en la siguiente figura.
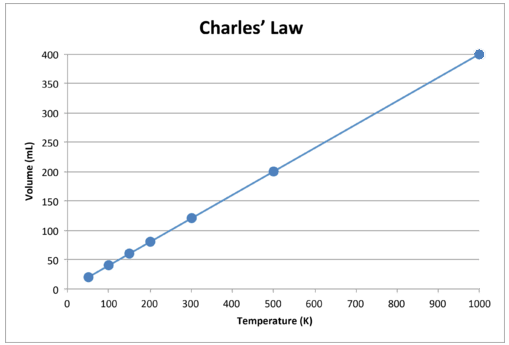
Figura\(\PageIndex{2}\): El volumen de un gas aumenta a medida que aumenta la temperatura Kelvin.
Observe que la línea va exactamente hacia el origen, es decir, que a medida que la temperatura absoluta del gas se acerca a cero, su volumen se acerca a cero. Sin embargo, cuando un gas se lleva a temperaturas extremadamente frías, sus moléculas eventualmente se condensarían en estado líquido antes de alcanzar el cero absoluto. La temperatura a la que se produce este cambio al estado líquido varía para los diferentes gases.
La Ley de Carlos también se puede utilizar para comparar las condiciones cambiantes de un gas. Ahora usamos\(V_1\) y\(T_1\) para representar el volumen inicial y la temperatura de un gas, mientras\(V_2\) y\(T_2\) representamos el volumen y la temperatura finales. La relación matemática de la Ley de Carlos se convierte en:
\[\frac{V_1}{T_1} = \frac{V_2}{T_2}\nonumber \]
Esta ecuación se puede utilizar para calcular cualquiera de las cuatro cantidades si se conocen las otras tres. La relación directa sólo se mantendrá si las temperaturas se expresan en Kelvin. Las temperaturas en Celsius no funcionarán. Recordemos la relación que\(\text{K} = \: ^\text{o} \text{C} + 273\).
Ejemplo\(\PageIndex{1}\)
Un globo se llena a un volumen de\(2.20 \: \text{L}\) a una temperatura de\(22^\text{o} \text{C}\). Luego se calienta el balón a una temperatura de\(71^\text{o} \text{C}\). Encuentra el nuevo volumen del globo.
Paso 1: Enumere las cantidades conocidas y planifique el problema.
Conocido
- \(V_1 = 2.20 \: \text{L}\)
- \(T_1 = 22^\text{o} \text{C} = 295 \: \text{K}\)
- \(T_2 = 71^\text{o} \text{C} = 344 \: \text{K}\)
Desconocido
Usa la Ley de Carlos para resolver por el volumen desconocido\(\left( V_2 \right)\). Las temperaturas se han convertido primero en Kelvin.
Paso 2: Resolver.
Primero, reorganizar la ecuación algebraicamente para resolver para\(V_2\).
\[V_2 = \frac{V_1 \times T_2}{T_1}\nonumber \]
Ahora sustituya las cantidades conocidas en la ecuación y resuelva.
\[V_2 = \frac{2.20 \: \text{L} \times 344 \: \text{K}}{295 \: \text{K}} = 2.57 \: \text{L}\nonumber \]
Paso 3: Piensa en tu resultado.
El volumen aumenta a medida que aumenta la temperatura. El resultado tiene tres cifras significativas.

