14.14: Ley de Dalton de Presiones Parciales
- Page ID
- 71151
La atmósfera de Venus es marcadamente diferente a la de la Tierra. Los gases en la atmósfera venusiana son dióxido de\(96.5\%\) carbono y\(3\%\) nitrógeno. La presión atmosférica sobre Venus es aproximadamente 92 veces la de la Tierra, por lo que la cantidad de nitrógeno en Venus aporta una presión muy superior\(2700 \: \text{mm} \: \ce{Hg}\). Y no hay oxígeno presente, así que los humanos no podían respirar ahí. No es que alguien quiera ir a Venus, la temperatura de la superficie suele haber terminado\(460^\text{o} \text{C}\).
Ley de Dalton de Presiones Parciales
La presión del gas es el resultado de colisiones entre las partículas de gas y las paredes internas de su contenedor. Si se agrega más gas a un contenedor rígido, la presión del gas aumenta. Las identidades de los dos gases no importan. John Dalton, el químico inglés que propuso la teoría atómica, también estudió mezclas de gases. Encontró que cada gas en una mezcla ejerce una presión independientemente de cada otro gas en la mezcla. Por ejemplo, nuestra atmósfera está compuesta por aproximadamente\(78\%\) nitrógeno y\(21\%\) oxígeno, con cantidades menores de varios otros gases que componen el resto. Dado que el nitrógeno constituye las partículas\(78\%\) de gas en una muestra dada de aire, ejerce\(78\%\) de la presión. Si la presión atmosférica general es\(1.00 \: \text{atm}\), entonces la presión de solo el nitrógeno en el aire es\(0.78 \: \text{atm}\). La presión del oxígeno en el aire es\(0.21 \: \text{atm}\).
La presión parcial de un gas es la contribución que hace el gas a la presión total cuando el gas es parte de una mezcla. La presión parcial del nitrógeno está representada por\(P_{N_2}\). La ley de Dalton de presiones parciales establece que la presión total de una mezcla de gases es igual a la suma de todas las presiones parciales de los gases componentes. La ley de Dalton se puede expresar con la siguiente ecuación:
\[P_\text{total} = P_1 + P_2 + P_3 + \cdots\nonumber \]
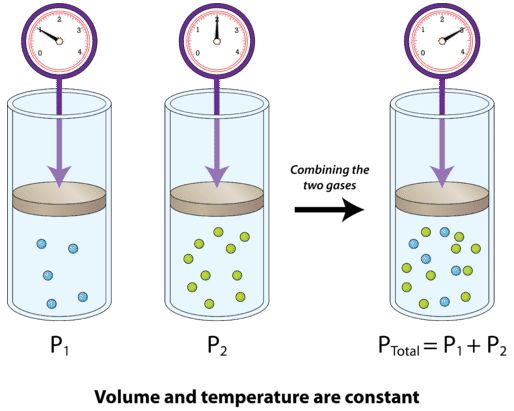
La siguiente figura muestra dos gases que se encuentran en recipientes separados, de igual tamaño, a la misma temperatura y presión. Cada uno ejerce una presión diferente,\(P_1\) y\(P_2\), reflejando el número de partículas en el contenedor. A la derecha, los dos gases se combinan en un mismo contenedor, sin cambio de volumen. La presión total de la mezcla gaseosa es igual a la suma de las presiones individuales. Si\(P_1 = 300 \: \text{mm} \: \ce{Hg}\) y\(P_2 = 500 \: \text{mm} \: \ce{Hg}\), entonces\(P_\text{total} = 800 \: \text{mm} \: \ce{Hg}\).
Resumen
- La presión parcial de un gas es la contribución que hace el gas a la presión total cuando el gas es parte de una mezcla.
- La presión total en un sistema es igual a las sumas de las presiones parciales de los gases presentes, de acuerdo con la Ley de Presiones Parciales de Dalton.

