17.7: Calorimetría
- Page ID
- 70478
En un momento, las calorías en los alimentos se midieron con un calorímetro de bomba. Una cantidad pesada del alimento se colocaría en el calorímetro y luego se selló el sistema y se llenó con oxígeno. Una chispa eléctrica encendió la mezcla alimento-oxígeno. La cantidad de calor liberado cuando los alimentos se quemaron dieron una idea de las calorías presentes dentro de los alimentos. Hoy en día, las calorías se calculan a partir del contenido de proteínas, carbohidratos y grasas de los alimentos (todo determinado por análisis químico).
Calorimetría
La calorimetría es la medición de la transferencia de calor dentro o fuera de un sistema durante una reacción química o proceso físico. Un calorímetro es un contenedor aislado que se utiliza para medir los cambios de calor. La mayoría de las reacciones que se pueden analizar en un experimento de calorimetría son líquidas o soluciones acuosas. Un calorímetro de uso frecuente y económico es un conjunto de copas de espuma anidadas equipadas con una tapa para limitar el intercambio de calor entre el líquido en la taza y el aire en los alrededores (ver figura abajo). En un experimento típico de calorimetría, se dispensan volúmenes específicos de los reactivos en recipientes separados y se mide la temperatura de cada uno. Luego se mezclan en el calorímetro, que inicia la reacción. La mezcla reaccionante se agita hasta que se completa la reacción, mientras que la temperatura de la reacción se monitorea continuamente.
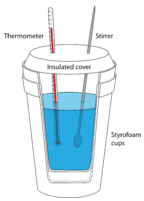
La clave de todos los experimentos de calorimetría es la suposición de que no hay intercambio de calor entre el calorímetro aislado y la habitación. Consideremos el caso de que se produzca una reacción entre reactivos acuosos: el agua en la que se han disuelto los sólidos es el entorno, mientras que las sustancias disueltas son el sistema. El cambio de temperatura que se mide es el cambio de temperatura que se está produciendo en los alrededores. Si la temperatura del agua aumenta a medida que se produce la reacción, la reacción es exotérmica. El sistema liberó calor al agua circundante. Una reacción endotérmica absorbe el calor del entorno, por lo que la temperatura del agua disminuye a medida que el calor sale del entorno para ingresar al sistema.
El cambio de temperatura del agua se mide en el experimento y el calor específico del agua se puede utilizar para calcular el calor absorbido por el entorno\(\left( q_\text{surr} \right)\).
\[q_\text{surr} = m \times c_p \times \Delta T\nonumber \]
En la ecuación,\(m\) es la masa del agua,\(c_p\) es el calor específico del agua, y\(\Delta T\) es\(T_f - T_i\). El calor absorbido por el entorno es igual, pero opuesto en signo, al calor liberado por el sistema. Debido a que el cambio de calor se determina a presión constante, el calor liberado por el sistema\(\left( q_\text{sys} \right)\) es igual al cambio de entalpía\(\left( \Delta H \right)\).
\[q_\text{sys} = \Delta H = -q_\text{surr} = - \left( m \times c_p \times \Delta T \right)\nonumber \]
El signo de\(\Delta H\) es positivo para una reacción endotérmica y negativo para una reacción exotérmica.
Ejemplo\(\PageIndex{1}\)
En un experimento,\(25.0 \: \text{mL}\) de\(1.00 \: \text{M} \: \ce{HCl}\) at\(25.0^\text{o} \text{C}\) se agrega a\(25.0 \: \text{mL}\) de\(1.00 \: \text{M} \: \ce{NaOH}\) at\(25.0^\text{o} \text{C}\) en un calorímetro de copa de espuma. Se produce una reacción y la temperatura se eleva a\(32.0^\text{o} \text{C}\). Calcular el cambio\(\left( \Delta H \right)\) de entalpía\(\text{kJ}\) para esta reacción. Supongamos que las densidades de las soluciones son\(1.00 \: \text{g/mL}\) y que su calor específico es el mismo que el del agua.
Solución
Paso 1: Enumere las cantidades conocidas y planifique el problema.
Conocido
- \(c_p = 4.18 \: \text{J/g}^\text{o} \text{C}\)
- \(V_\text{final} = 25.0 \: \text{mL} + 25.0 \: \text{mL} = 50.0 \: \text{mL}\)
- \(\Delta T = 32.0^\text{o} \text{C} - 25.0^\text{o} \text{C} = 7.0^\text{o} \text{C}\)
- Densidad\(= 1.00 \: \text{g/mL}\)
Desconocido
El volumen y la densidad se pueden utilizar para encontrar la masa de la solución después de la mezcla. Después calcula el cambio en la entalpía usando\(\Delta H = q_\text{sys} = -q_\text{surr} = - \left( m \times c_p \times \Delta T \right)\).
Paso 2: Resolver.
\[\begin{align*} m &= 50.0 \: \text{mL} \times \frac{1.00 \: \text{g}}{\text{mL}} = 50.0 \: \text{g} \\ \Delta H &= - \left( m \times c_p \times \Delta T \right) = - \left( 50.0 \: \text{g} \times 4.18 \: \text{J/g}^\text{o} \text{C} \times 7.0^\text{o} \text{C} \right) = -1463 \: \text{J} = -1.5 \: \text{kJ} \end{align*}\nonumber \]
Paso 3: Piensa en el resultado.
El cambio de entalpía es negativo porque la reacción libera calor al entorno, resultando en un aumento en la temperatura del agua.
Resumen
- La calorimetría es la medición de la transferencia de calor dentro o fuera de un sistema durante una reacción química o proceso físico.
- Un calorímetro es un contenedor aislado que se utiliza para medir los cambios de calor.
- Se ilustran los cálculos que implican cambios de entalpía.

