17.8: Ecuaciones Termoquímicas
- Page ID
- 70448
Calentar una casa es cada vez más caro. La decisión de usar gas, petróleo, electricidad o madera puede ser multifacética. Parte de la decisión se basa en qué combustible proporcionará la mayor cantidad de liberación de energía cuando se quema. Los estudios de termoquímica pueden ser muy útiles para obtener información confiable para tomar estas decisiones importantes.
Ecuación Termoquímica
Cuando se quema gas metano, se libera calor, haciendo que la reacción sea exotérmica. Específicamente, la combustión\(1 \: \text{mol}\) de metano libera 890.4 kilojulios de energía térmica. Esta información se puede mostrar como parte de una ecuación equilibrada:
\[\ce{CH_4} \left( g \right) + 2 \ce{O_2} \left( g \right) \rightarrow \ce{CO_2} \left( g \right) + 2 \ce{H_2O} \left( l \right) + 890.4 \: \text{kJ}\nonumber \nonumber \]
La ecuación nos dice que\(1 \: \text{mol}\) del metano se combina con\(2 \: \text{mol}\) de oxígeno para producir\(1 \: \text{mol}\) de dióxido de carbono y\(2 \: \text{mol}\) de agua. En el proceso,\(890.4 \: \text{kJ}\) se libera y así se escribe como producto de la reacción. Una ecuación termoquímica es una ecuación química que incluye el cambio de entalpía de la reacción. El proceso en la ecuación termoquímica anterior se puede mostrar visualmente en la siguiente figura.
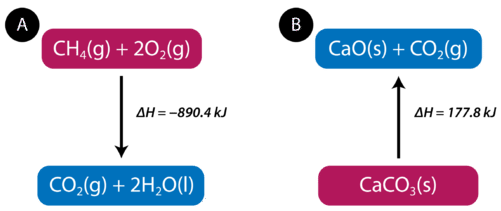
En el ejemplo de combustión de metano, el cambio de entalpía es negativo porque el sistema está liberando calor. Por lo tanto, la entalpía general del sistema disminuye. El calor de reacción es el cambio de entalpía para una reacción química. En el caso anterior, el calor de reacción es\(-890.4 \: \text{kJ}\). La reacción termoquímica también se puede escribir de esta manera:
\[\ce{CH_4} \left( g \right) + 2 \ce{O_2} \left( g \right) \rightarrow \ce{CO_2} \left( g \right) + 2 \ce{H_2O} \left( l \right) \: \: \: \: \: \Delta H = -890.4 \: \text{kJ}\nonumber \nonumber \]
Los calores de reacción se miden típicamente en kilojulios. Es importante incluir los estados físicos de los reactivos y productos en una ecuación termoquímica, ya que el valor del\(\Delta H\) depende de esos estados.
Las reacciones endotérmicas absorben energía del entorno a medida que ocurre la reacción. Cuando\(1 \: \text{mol}\) de carbonato de calcio se descompone en\(1 \: \text{mol}\) de óxido de calcio y\(1 \: \text{mol}\) de dióxido de carbono,\(177.8 \: \text{kJ}\) de calor se absorbe. El proceso se muestra visualmente en la figura anterior (B). La reacción termoquímica se muestra a continuación.
\[\ce{CaCO_3} \left( s \right) + 177.8 \: \text{kJ} \rightarrow \ce{CaO} \left( s \right) + \ce{CO_2} \left( g \right)\nonumber \nonumber \]
Debido a que el calor es absorbido por el sistema, el\(177.8 \: \text{kJ}\) se escribe como un reactivo. El calor de reacción es positivo para una reacción endotérmica.
\[\ce{CaCO_3} \left( s \right) \rightarrow \ce{CaO} \left( s \right) + \ce{CO_2} \left( g \right) \: \: \: \: \: \Delta H = 177.8 \: \text{kJ}\nonumber \nonumber \]
La forma en que se escribe una reacción influye en el valor del cambio de entalpía para la reacción. Muchas reacciones son reversibles, lo que significa que el (los) producto (s) de la reacción son capaces de combinar y reformar el (los) reactivo (s). Si se escribe una reacción en la dirección inversa, el signo de los\(\Delta H\) cambios. Por ejemplo, podemos escribir una ecuación para la reacción del óxido de calcio con el dióxido de carbono para formar carbonato de calcio:
\[\ce{CaO} \left( s \right) + \ce{CO_2} \left( g \right) \rightarrow \ce{CaCO_3} \left( s \right) + 177.8 \: \text{kJ}\nonumber \nonumber \]
La reacción es exotérmica y por lo tanto el signo del cambio de entalpía es negativo.
\[\ce{CaO} \left( s \right) + \ce{CO_2} \left( g \right) \rightarrow \ce{CaCO_3} \left( s \right) \: \: \: \: \: \Delta H = -177.8 \: \text{kJ}\nonumber \nonumber \]
Resumen
- Una ecuación termoquímica es una ecuación química que incluye el cambio de entalpía de la reacción.
- El calor de reacción es el cambio de entalpía para una reacción química.

